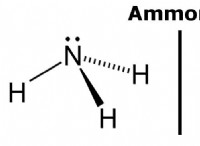
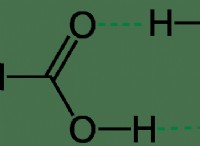
1 단계 :적정에 사용 된 NAOH의 두더지 계산
NaOH의 두더지 =NaOH의 농도 × NaOH의 부피
NaOH의 두더지 =0.108 m × 31.43 ml / 1000 ml / L
NaOH의 두더지 =0.0033846 몰
2 단계 :아세트산의 두더지를 결정합니다
NaOH와 아세트산 사이의 반응은 1 :1 화학량 론이기 때문에, 아세트산의 두부는 적정에 사용 된 NaOH의 두부와 동일하다.
아세트산 몰 =0.0033846 몰
3 단계 :아세트산 질량을 계산합니다
아세트산의 몰 질량 (CH3COOH) =60.05 g/mol
아세트산 질량 =아세트산의 두더지 × 아세트산의 몰 질량
아세트산 질량 =0.0033846 몰 × 60.05 g/mol
아세트산 질량 =0.2031 그램
4 단계 :식초에서 아세트산 백분율을 계산하십시오
아세트산의 백분율 =(아세트산 / 식초의 질량) × 100%
아세트산의 백분율 =(0.2031 g / 4.441 g) × 100%
아세트산의 백분율 =4.572 %
따라서, 식초 샘플은 4.572% 아세트산을 함유한다.