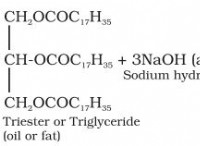1. 각 요소의 몰 질량을 계산하십시오.
-은 (Ag) :어금니 질량 =107.87 g/mol
- 질소 (N) :어금니 질량 =14.01 g/mol
- 산소 (O) :어금니 질량 =16.00 g/mol
2. 각 요소의 두더지를 계산하십시오.
- Ag의 두더지 =63.50 g / 107.87 g / mol =0.588 Moles
-N =8.25 g / 14.01 g / mol =0.589 Moles의 두더지
-O =28.25 g / 16.00 g / mol =1.766 몰의 몰
3. 각 요소의 상대 비율을 결정하십시오.
-Ag :0.588 몰 / 1.766 몰 =0.333
-N :0.589 몰 / 1.766 몰 =0.334
-O :1.766 몰 / 1.766 몰 =1
4. 상대적 비율을 단순화하여 정수를 얻습니다.
-Ag :0.333 ≈ 1
-N :0.334 ≈ 1
-O :1
5. 화합물의 경험적 공식은 Agno이다.
6. 경험적 공식 질량을 계산하십시오.
경험적 공식 질량 (Agno) =(1 x 107.87 g/mol) + (1 x 14.01 g/mol) + (1 x 16.00 g/mol) =169.88 g/mol
계산 된 경험적 공식 질량은 169.91g의 주어진 총 몰 질량에 매우 가깝습니다. 이는 경험적 공식이 정확하다는 것을 시사합니다.