스핀 퇴행 :간단한 설명
스핀 퇴행성은 스핀 방향이 다른 전자가 주어진 궤도에서 동일한 에너지 수준을 갖는다는 사실을 말합니다. . 이는 전자가 스핀 업 또는 스핀 다운 방향을 갖는 동안 동일한 에너지 수준을 차지할 수 있음을 의미합니다.
여기에 고장이 있습니다 :
* 스핀 : 전자는 스핀이라는 고유 특성을 가지며, 이는 회전 운동으로 시각화 될 수 있습니다. 이 회전은 자기 모멘트를 생성하며, 이는 스핀 업 (↑) 또는 스핀 다운 (↓) 일 수 있습니다.
* 에너지 수준 : 에너지 수준은 원자에서 전자의 에너지 상태를 설명합니다.
* 퇴행 : 퇴행성은 여러 상태가 동일한 에너지를 가지고 있음을 의미합니다. 스핀 퇴행성에서는 두 개의 스핀 상태 (스핀 업 및 스핀 다운)가 동일한 에너지 수준을 갖습니다.
예 :
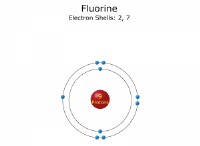
수소 원자를 고려하십시오. 전자 구성은 1S¹입니다. 이것은 전자가 1s 궤도를 차지한다는 것을 의미합니다. 1s 궤도는 스핀 업과 스핀 다운이있는 2 개의 전자를 수용 할 수 있습니다. 이 두 전자는 동일한 에너지 수준을 가지며 스핀 퇴화를 나타냅니다.
스핀 퇴행성이 중요한 이유는 무엇입니까?
* Pauli 배제 원칙 : 스핀 퇴행성은 Pauli 배제 원리와 직접 관련이 있으며, 이는 원자의 두 전자가 동일한 양자 수 세트를 가질 수 없음을 나타냅니다. 이것은 두 개의 전자가 동일한 궤도를 차지할 수 있지만 스핀 방향이 다른 것을 의미합니다.
* 궤도의 충전 : 스핀 퇴행은 여러 전자로 궤도를 충전 할 수있게합니다. 이것은 원자의 전자 구성과 화학 결합의 형성을 이해하는 데 중요합니다.
* 분광 연구 : 스핀 퇴행성은 분광 실험에서 관찰 될 수있는 원자와 분자의 에너지 수준에 영향을 미칩니다.
요약 :
스핀 퇴행성은 반대 스핀 방향을 가진 전자가 궤도 내에서 동일한 에너지 수준을 갖는 이유를 설명하는 양자 역학의 기본 개념입니다. 이 퇴행성은 원자와 분자의 구조와 특성을 이해하는 데 중요한 역할을합니다.