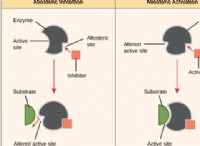
자유 에너지 다이어그램 이해
* 자유 에너지 (G) : 세로 축은 시스템의 안정성을 측정하는 깁스 자유 에너지를 나타냅니다. 자유 에너지 값이 낮 으면 안정성이 높아집니다.
* 반응 진행 : 수평 축은 왼쪽의 반응물에서 오른쪽의 제품으로 이동하여 반응의 진행을 나타냅니다.
* 전이 상태 : 다이어그램의 피크는 전이 상태를 나타내며, 결합이 파손되고 형성되는 반응에서 가장 높은 에너지 포인트입니다.
* ΔG (자유 에너지 변화) : 반응물과 생성물 사이의 자유 에너지의 차이는 ΔG로 표시됩니다. 음성 ΔG는 제품 형성을 선호하는 자발적 반응을 나타냅니다.
제품 형성을 선호하는 시나리오
1. 낮은 ΔG (음수 값) :
* 가장 근본적인 요인 :음성 ΔG와의 반응은 생성물이 반응물보다 더 안정적임을 의미합니다. 이 시스템은 자연스럽게 제품 형성으로 이동하여 평형에 도달하는 경향이 있습니다.
2. 역 반응을위한 높은 활성화 에너지 :
* 역 반응에 대한 활성화 에너지 (에너지 장벽)가 전방 반응 (생성물에 반응)의 활성화 에너지 (에너지 장벽)가 상당히 높으면, 순방향 반응이 선호 될 것이다. 반응물이 그 반대보다 제품으로 전환하는 것이 더 쉬울 것입니다.
3. 조건의 변화 (Le Chatelier의 원리) :
* 온도 :
* 발열 반응 (ΔH 음성) : 온도 감소는 제품 형성을 선호합니다.
* 흡열 반응 (ΔH 양성) : 온도가 증가하면 제품 형성이 있습니다.
* 압력 :
* 반응에 가스가 포함되고 제품 측에 더 많은 두더지 가스가 있으면 압력이 증가하면 제품 형성이 선호됩니다.
* 반응에 가스가 포함되고 반응물 측에 더 많은 두더지 가스가 있으면 압력 감소가 제품 형성을 선호합니다.
* 농도 :
* 반응물의 농도를 증가시키는 것은 생성물 형성을 선호 할 것이다.
* 제품의 농도를 감소시키는 것은 제품 형성을 선호합니다.
자유 에너지 다이어그램에서 시각화 :
* 낮은 ΔG : 제품은 다이어그램의 반응물보다 에너지 수준이 낮습니다.
* 높은 역 활성화 에너지 : 역 반응에 대한 다이어그램의 피크는 전방 반응의 피크보다 높을 것입니다.
중요한 참고 : 반응이 생성물 형성을 선호하더라도 모든 반응물이 생성물로 바뀌는 것은 아닙니다. 평형은 순방향 및 역 반응의 속도가 동일 해짐을 의미하여 반응물 및 생성물의 일정한 비율을 초래합니다.
분석하려는 특정 무료 에너지 다이어그램이 있으면 알려 주시면 해석 할 수 있습니다.