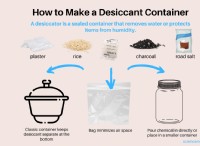
이유는 다음과 같습니다.
* 중앙 원자 : 유황은 중심 원자입니다.
* 원자가 전자 : 황은 6 개의 원자가 전자를 가지며 각 수소에는 1이 있습니다.
* 본딩 : 황은 2 개의 수소 원자와 2 개의 단일 결합을 형성합니다.
* 고독한 쌍 : 유황에는 2 개의 고독한 전자가 있습니다.
* VSEPR 이론 : 황의 두 고독 쌍은 결합 쌍을 격퇴하여 수소 원자를 더 가깝게 밀어냅니다.
중앙 원자 주위에 2 개의 결합 쌍 및 2 개의 고독 쌍의 이러한 배열은 결합 각도가 109.5도 미만의 구부러진 또는 각도 모양을 초래합니다.