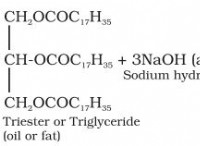삼투압 이해
* 삼투압 용액에서 용질 입자의 총 농도의 척도입니다. 리터당 삼투 (OSM/L)로 표현됩니다.
* One Osmole 용질의 6.022 x 10²³ 입자 (Avogadro의 수)를 나타냅니다.
삼투압 계산
1. 해리 : 암모늄 포스페이트는 다음과 같이 용액에 분리됩니다.
(nh₄) ₄po₄ → 3 nh₄⁺ + po₄ran
2. 이온 수 : 이것은 (NH₄) ₃ 푸의 각 두더지가 4 몰의 이온 (3 몰의 NH₄⁺ 및 1 몰의 po₄³⁻)을 생성한다는 것을 의미합니다.
3. 삼투압 계산 :
* Molarity (m) =0.4 m
* 공식 단위 당 이온 수 =4
* 삼투압 =몰토리티 x 이온 수
* 삼투압 =0.4 m x 4 =1.6 osm/l
따라서, 0.4m 암모늄 인산염 용액의 삼투압은 1.6 OSM/L이다. .