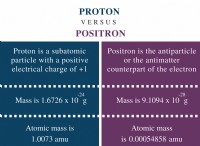
다음은 고장입니다.
* 말단 원자 : 이들은 분자 끝의 원자이며 중앙 원자에 직접 결합됩니다.
* 중앙 원자 : 이것은 분자의 중간에있는 원자이며, 2 개 이상의 말단 원자에 결합됩니다.
결합 각은 분자 형상의 중요한 측면입니다. 분자의 모양, 특성 및 반응성에 영향을 미칩니다. 결합 각도에 영향을 미치는 요인은 다음과 같습니다.
* 중앙 원자 주위의 전자 쌍 : 고독한 쌍의 전자는 결합 쌍보다 더 강한 반발력을 가하고 결합 된 원자를 함께 밀어 넣고 결합 각도를 감소시킨다.
* 중앙 원자의 혼성화 : 다른 유형의 혼성화 (SP, SP², SP³)는 다른 결합 각도를 초래합니다.
* 중앙 및 말단 원자의 크기 : 더 큰 원자는 약간 더 큰 결합 각도를 가질 수 있습니다.
예 :
* 물 (h>o) : 두 수소 원자와 산소 원자 사이의 결합 각은 대략 104.5 °입니다.
* 메탄 (ch₄) : 2 개의 수소 원자와 탄소 원자 사이의 결합 각은 109.5 °입니다.
* 이산화탄소 (Co₂) : 두 산소 원자와 탄소 원자 사이의 결합 각은 180 °입니다.
특정 분자의 결합 각도를 이해하려면 중앙 원자 주위의 전자 쌍의 배열에 기초하여 분자 형태를 예측하는 데 도움이되는 VSEPR 이론 (VANENCE SHELL Electron Pair 반발 이론)을 고려하는 것이 중요합니다.