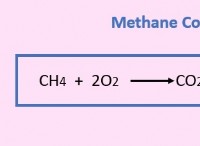
금속 :
* 알칼리 금속 : 불소와 폭발하여 이온 성 불소 (예를 들어, LIF, NAF, KF)를 형성합니다.
* 알칼리성 지구 금속 : 불소와 격렬하게 반응하여 이온 성 불소를 형성합니다 (예 :Bef2, Mgf2, Caf2).
* 전이 금속 : 상이한 산화 상태 (예를 들어, Fef2, Fef3, Nif2)를 갖는 다양한 불소를 형성 할 수있다.
비금속 :
* 수소 : 매우 강한 산인 불소 (HF)를 형성합니다.
* 탄소 : 냉매 및 플라스틱에 사용되는 다양한 플루오로 카본 (예 :CF4, C2F6)을 형성합니다.
* 질소 : 혈장 에칭에 사용되는 질소 트리 플루오 라이드 (NF3)를 형성합니다.
* 산소 : 강력한 산화제 인 산소 디 플루오 라이드 (OF2)를 형성합니다.
* 인 : 인 트리 플루오 라이드 (PF3) 및 인 펜타 플루오 라이드 (PF5)를 형성합니다.
* 황 : 절연체로 사용되는 불활성 가스 인 황 6 헥사 플루오 라이드 (SF6)를 형성합니다.
* 할로겐 : interhalogen 화합물 (예 :CLF, BRF, IF)을 형성 할 수 있습니다.
중요한 점 :
* 불소와 다른 원소 사이의 결합 강도는 이들 사이의 전기 음성 차이에 달려 있습니다.
* 불소는 이온 성 및 공유 결합을 모두 형성 할 수 있습니다.
* 불소는 반응성이 높고 그 화합물은 종종 독성적이고 부식성입니다.
참고 : 불소의 극한 반응성은 분리하고 다루기가 어렵습니다. 그것은 일반적으로 원소 형태가 아닌 화합물에서 발견됩니다.