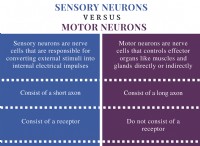
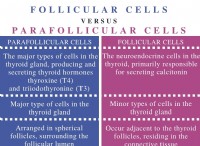
다음은 고장입니다.
* 양성자 (H+) : 전자를 잃어버린 수소 원자는 양으로 하전 된 핵 만 남겨 둡니다.
* 물 분자 (H2O) : 산소 원자 상에 2 개의 고독한 전자 쌍의 전자 쌍을 함유하는 2 개의 수소 원자 및 1 개의 산소 원자를 갖는 분자.
* 수화 : 다른 분자 또는 이온과 주변 및 상호 작용하는 물 분자의 과정.
형성 :
양성자가 물 분자를 만날 때, 그것은 산소 원자에서 고독한 전자 쌍과 강한 정전기 상호 작용을 형성한다. 이 상호 작용은 공유 결합 의 형성으로 이어진다. , hydronium (H3O+) 이라는 새로운 분자를 생성합니다 .
왜 h+가 아닌가?
우리는 종종 단순성을 위해 양성자를 H+로 표현하지만, 물에서 유리 양성자로는 존재하지 않습니다. 알몸 양성자의 매우 높은 전하 밀도는 반응성이 높고 물 분자와의 결합을 형성하는 경향이 있습니다.
의 중요성 :
히드로 늄 이온은 다음을 포함하여 많은 화학 및 생물학적 과정에서 중요합니다.
* 산도 : 용액에서 하이드로 늄 이온의 농도는 그 산도를 결정한다.
* 산-염기 반응 : 히드로 늄 이온은 산-염기 반응에서 생성되고 염기와 반응하여 물을 형성한다.
* 생물학적 시스템 : 하이드로 늄 이온은 효소 활성, 막 수송 및 pH 조절에 역할을한다.
요약 :
수화 된 양성자 (Hydronium 이온, H3O+)는 화학의 기본 종이며, 양성자 화 된 물 형태를 나타내며 용액의 산성 특성을 담당한다. 산-염기 화학 및 다양한 생물학적 및 화학 공정에서의 역할을 이해하는 것이 필수적이다.