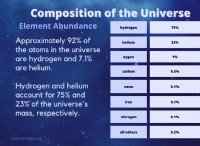
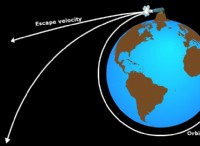
이유는 다음과 같습니다.
* 이온 성 특성은 주로 결합을 형성하는 두 원자 사이의 전기 음성 차이에 의해 결정됩니다. . 차이가 클수록 결합이 더 많이 이온 성이됩니다.
* 더 큰 양이온은 전기 음성이 낮은 경향이 있습니다. 외부 전자가 핵에서 멀어지고 덜 단단히 고정되어 있기 때문입니다.
* 작은 음이온은 더 높은 전기 음성을 갖는 경향이 있습니다. 그들의 전자는 핵에 더 가깝고 더 강한 매력을 경험합니다.
따라서, 더 큰 양이온과 작은 음이온의 조합 더 큰 전기 음성 차이로 이어진다 및 더 많은 이온 성격 .
여기 단순화 된 설명이 있습니다 :
양이온과 음이온 사이의 줄다리기를 상상해보십시오.
* 큰 양이온 전자에 그립이 약합니다.
* A 작은 음이온 전자에 더 강한 그립이 있습니다.
그립의 차이가 클수록 전자가 음이온으로 끌어 당겨서 결합을 더 이온으로 만들 가능성이 높습니다.
요약 :
더 큰 양이온은 더 높은 전기 음성 차이에 기여하지만 유일한 요인은 아닙니다. 음이온의 크기 또한 중요한 역할을합니다.
예 :
* naCl : Na+는 더 큰 양이온이고 Cl-는 더 작은 음이온입니다. 이 조합은 상당한 전기 음성 차이와 높은 이온 결합으로 이어진다.
* csf : CS+는 매우 큰 양이온이며 F-는 매우 작은 음이온입니다. 이 조합은 또한 큰 전기 음성 차이와 매우 이온 성 결합을 초래합니다.
참고 :
* 이온 성 특성은 절대 값이 아니라 스펙트럼입니다. 결합은이 스펙트럼에서의 위치에 기초하여보다 이온 성 또는 공유로 간주 될 수있다.
* 관련된 전자의 수와 같은 다른 요인들도 이온 성 특성에 영향을 줄 수 있습니다.