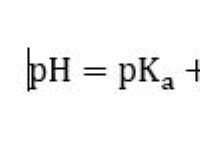그러나, CO2는 선형 분자이며, 이는 2 개의 산소 원자가 탄소 원자의 반대쪽에 있음을 의미한다. 이 대칭 배열은 쌍극자 모멘트를 초래한다 두 C =O 채권 중 서로를 취소 .
이렇게 생각하십시오 :산소 원자가 전자를 자신을 향해 당기는 것처럼 각 C =O 결합을 줄다리기로 밧줄로 상상해보십시오. 산소 원자는 대칭 적으로 위치되므로, 풀은 동일하고 반대이며, 분자의 순 제로 풀을 초래합니다.
따라서, 개별 C =O 결합이 극성이지만, 분자는 전체 쌍극자 모멘트가 없으며 nonpolar 로 간주된다. .