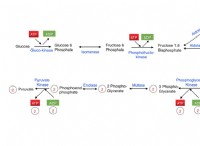
산화 환원 반응 이해
* 산화 : 전자 손실, 산화 수의 증가.
* 감소 : 전자 증가, 산화 수 감소.
* 감소제 : 다른 물질을 감소시키는 물질 (그리고 그 자체는 산화됩니다).
* 산화제 : 다른 물질을 산화시키는 물질은 산화되며 (그리고 그 자체가 감소됩니다).
반응 분석
당신이 제공 한 불균형 반응은 다음과 같습니다.
```
2 KMNO4 + 3 NA2SO3 + H2O → 2 MNO2 + SO4 + 2 KOH
```
명확성을 위해 균형을 맞추자 :
```
2 KMNO4 + 3 NA2SO3 + H2O → 2 MNO2 + 3 NA2SO4 + 2 KOH
```
이제 주요 요소의 산화 상태를 살펴 보겠습니다.
* 망간 (Mn) :
* KMNO4 (칼륨 과망간산산염)에서, Mn의 산화 상태는 +7입니다.
* MNO2 (이산화 망간)에서 Mn의 산화 상태는 +4입니다.
* mn이 감소되고 있습니다 (전자 얻기)
* 황 (s) :
* Na2SO3 (나트륨 설 파이트)에서 S의 산화 상태는 +4입니다.
* Na2SO4 (황산나트륨)에서 S의 산화 상태는 +6입니다.
* s는 산화되고있다 (전자 손실)
환원제 식별
황이 산화되고 있기 때문에 (전자를 잃는), 감소 제 입니다. . KMNO4의 망간을 감소시킨다.
따라서, Na2SO3 (나트륨 설파이트)은이 반응에서 환원제이다.