* 강한 산화제 : 농축 황산은 매우 강한 산화제입니다. 이것은 전자를 쉽게 얻는 것을 의미하여 다른 물질이 전자를 잃게한다 (산화된다). 황화물과 반응 할 때, 그것은 h₂s를 방출하는 대신 황화물 이온 (s²⁻)을 산화시킬 것이다.
* 경쟁 반응 : 농축 된 황산과 황화물 사이의 반응은 주로 h₂s가 아닌 이산화황 (SO₂) 가스를 생성 할 것이다. 반응은 또한 사용 된 특정 황화물에 따라 황을 생성 할 수있다.
여기 단순화 된 예는 다음과 같습니다.
철 황화물 (FES)을 농축 황산과 반응하는 경우 :
fes + h ₄so₂ → feso₄ + h₂o + so₂
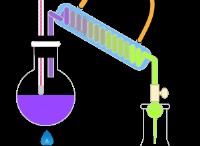
HAS를 준비하려면 황화물 이온을 산화시키지 않는 약한 산이 필요합니다. 일반적인 방법은 다음과 같습니다.
1. 금속 황화물과 희석산 (염산과 같은)과 반응 :
fes (s) + 2hcl (aq) → fecl₂ (aq) + h₂s (g)
2. 금속 황화물의 물과의 반응 :
al₂s₂ (s) + 6H₂O (L) → 2AL (OH) ₃ (S) + 3H₂S (g)
중요한 참고 : 황화수소는 계란 냄새가 나는 독성 가스입니다. 환기가 잘되는 지역에서 극도의 관리로 처리하는 것이 중요합니다.