암모니아 하나의 질소 원자와 3 개의 수소 원자로 만들어진 공식 NH3을 갖는 화학 화합물이다. 몰 질량 NH3 (암모니아)은 두더지 당 17.031 g입니다. 화학적 특성 암모니아의 암모니아는 높은 안정성을 갖는 암모니아, 공기 중에 가연성이 있고, 약 800 ℃에서 플래티넘-로디움 촉매와 결합 될 때 산화 질소 형성을 포함한다.
.두더지는 무엇입니까?
화학 물질의 몰 질량은 그 물질의 단일 두더지에 의해 소유되는 질량입니다. 물질의 몰 질량이 왜 중요한지 이해하려면 먼저 두더지를 정의해야합니다. 두더지는 화학 물질에 대한 측정 단위이며 화학자 나 다른 과학자들은 어느 정도의 기본 실체 (분자 또는 원자)가 어느 정도의 화학 물질 내에 있는지 결정할 수 있습니다. 하나의 두더지의 기본 개체의 수는 카본 12 g의 원자 수와 동일합니다.이 수는 Avogadro의 수라고하며, 이는 6.022 × 10^23입니다. 이것은 하나의 두더지에서 발견되는 23 차 기본 엔티티에 6.022 × 10이 있음을 의미합니다.
그렇다면 왜 두더지가 화학에서 중요한가? 화학적 변화가 발생할 때 수십억의 원자가 재 배열되기 때문에 많은 초등 단체를 나타내는 측정 단위를 갖는 것이 중요합니다. 이 수십억 개의 원자는 현실적으로 시각화되거나 적시에 표현 될 수는 없지만 과학자들은 여전히 전체 원자의 양을 나타내는 방법이 있어야합니다. 이러한 이유로, 두더지는 물질의 무게를 원자 수와 비교하는 데 사용되며, 무게는 원자 수와 비교할 때 단순히 경험적으로 정량화 될 수 있습니다.
두 가지 다른 화학 물질과 관련된 계산을 수행 할 때 Avogadro의 수와 두더지를 사용하여 필요합니다. Avogadro의 숫자를 사용하는 것은 분자가 결합하는 방식과 상호 작용의 특성을 모두 이해하는 데 중요합니다. 수소 원자가 하나의 산소 원자와 결합 될 때 두 분자의 물 분자를 어떻게 생성하는지 살펴 보겠습니다. 1 몰의 H2O는 2 몰의 수소와 하나의 산소로 만들어 졌으므로 1 몰의 H2O =2 × 6.022 × 1023의 수소 + 6.022 × 1023의 산소로 표시 될 수 있습니다.
.Avogadro 수의 주목할만한 특성 중 하나는 물질의 분자량이 주어진 물질의 몰 질량과 같다는 것입니다. 예를 들어, 물의 무게의 무게는 18.015 g, 물의 평균 무게는 18.015 원자 질량 단위 (AMU)입니다.
요약 :
물질의 분자량은 물질의 한 몰이 보유하는 질량과 같습니다. 예를 들어, 1 몰의 물 무게는 약 18.015g이고 18.015 원자 질량 단위는 물의 평균 분자량입니다.
어금니 질량이란 무엇이며 왜 중요한가?

물질의 몰 질량을 아는 것은 물질의 샘플과 물질의 질량을 서로 함께 연결하기 때문에 어금니 질량이 없으면 두더지의 수를 직접 측정 할 수 없기 때문입니다.
모든 원자 나 이온에는 자체 덩어리가 있으며, 그뿐만 아니라 물질의 모든 두더지에 대한 명확한 질량도 있습니다. 순수한 요소가있을 때, 그 요소의 원자의 두더지가 그램에있는 질량은 그 요소의 원자 질량과 동일합니다. 계산이 두더지 당 그램 또는 원자 질량 단위로 수행되는지 여부에 관계없이 사실입니다.
물질의 몰 질량은 물질의 질량을 해당 물질의 양으로 나눈 것과 같습니다. 두더지 당 그램은 어금니 질량을 측정하는 방법입니다. 예를 들어, 티타늄의 몰 질량은 두더지 당 47.88g 또는 47.8 amu입니다. 이것은 47.88g의 티타늄에 6.022 × 10에서 23 번째 티타늄 원자가 있음을 의미합니다.
두더지 당 그램의 원자 질량은 또한 그 요소의 특성 몰 질량과 동일하다. 물질의 몰 질량은 AMU의 원자 질량에 의해 두더지 당 1g 인 몰 질량 상수를 곱하는 것과 같은 대체 방법을 통해 결정될 수있다. 여러 종류의 원자를 갖는 화합물의 몰 질량을 결정하기 위해 다양한 구성 원자의 원자 질량을 합산하게됩니다. 예를 들어 NaCl의 몰 질량을 결정하려면 염소의 원자 질량과 나트륨의 원자 질량을 찾아야합니다. 나트륨의 원자 질량은 두더지 당 22.99g이고 염소의 원자 질량은 두더지 당 35.45g입니다. 두 가지 질량을 결합하여 두더지 당 58.44g, NaCl의 몰 질량을 얻습니다.
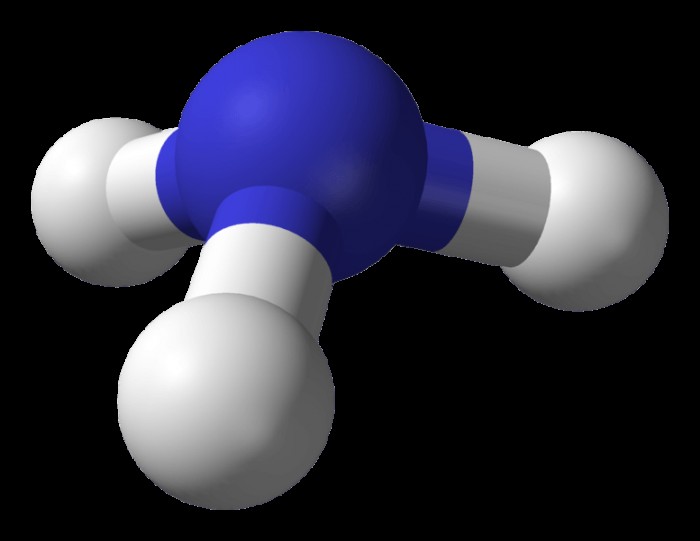
암모니아 구조
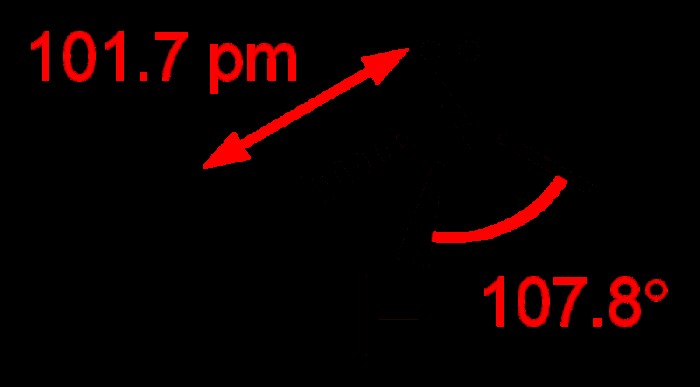
암모니아의 구조를 조사하면 그것이 공유 분자임을 보여줍니다. 3 개의 SP3 하이브리드 궤도의 중첩 및 3 개의 수소 궤도는 암모니아를 형성한다. 분자에는 또 다른 SP3 하이브리드 궤도가 있지만,이 마지막 궤도에는 고독한 쌍만 있습니다. 이 구조는 암모니아 분자가 삼각형 중간 모양을 가지고 있음을 의미합니다. 수소 질소-하이드로겐 결합의 각도는 107.3 °입니다. H 및 H 결합의 결합 각도는 109 ° 사면체 각도보다 약간 작습니다. H 및 H 결합의 각도는 고독한 쌍 결합이 NH 결합을 약간 안쪽으로 밀어 넣는 사실의 결과입니다. 고체 및 액체 상태에서 수소 결합은 암모니아의 연관성을 담당합니다.
암모니아의 물리적 특성
그러나 암모니아는 무색이지만 다른 무색 가스와 달리 무취는 아닙니다. 사실, 암모니아는 매우 매운 냄새를 띠고 흡입하면 기침, 질식 및 눈의 물을 유발할 수 있습니다. 또한 비눗물/알칼리성 맛이 있다고합니다. 암모니아는 공기보다 가벼워서 정기적 인 공기가 아래로 이동하고 암모니아가 높은 지역에 모일 때 대체됩니다. 암모니아는 수용성이며, 물은 약 1300 권의 암모니아 가스를 용해시킬 수 있습니다. 암모니아의 높은 수용성 덕분에 물 몸체에 모일 수는 없습니다. 암모니아는 약 10 개의 대기압이 적용될 때 실온에서 매우 쉽게 주류합니다. 액체 암모니아는 약 195.3K (-77.8 ° C)에서 얼어 붙을 것이며, 이는 고체 결정, 흰색 구조를 생성합니다. 하나의 대기압에서, 액체 암모니아는 239.6k (-33.5 ° C)에서 끓는다. 암모니아는 종종 증기의 높은 열열로 인해 냉매로 사용됩니다.
암모니아의 화학적 특성
암모니아의 주요 화학적 특성 중 하나는 열 안정성입니다. 암모니아는 매우 안정적인 화학 화합물이지만 가열 된 금속 촉매를 사용하거나 화합물을 통해 전기 방전을 통과시켜 질소와 수소로 분해 될 수 있습니다. 암모니아의 또 다른 화학적 특성은 공기 중에 가연성이 있고 산소 환경에서 화상을 입는다는 사실입니다. 산화 질소는 공기와 암모니아가 약 800 ° C에서 Rhodium-platinum 촉매를 통과 할 때 생성됩니다.
.암모니아는 물과 결합 될 때 혼잡합니다. 물이 끓으면 암모니아를 제거 할 수 있습니다. 암모니아는 약 15 ~ 25% 공기의 혼합물에서만 쉽게 연소되므로 매우 좁은 공기 혼합물이 있어야합니다. 그러나 화상을 입으면 황록색 불꽃이 생깁니다. 암모니아의 연소는 발열 반응을 통해 수소와 물을 생성합니다.
암모니아 분자는 다른 분자와 흥미로운 관계를 가지고 있습니다. 암모니아 분자는 고독한 전자 쌍을 다른 분자에 매우 자주 기증 할 것입니다. 이 속성은 루이스 기지와 유사하게 행동한다는 것을 의미합니다. NH3의 분자는 수용액에 배치 될 때 기증 반응에 따라 이온화됩니다. 암모니아가 고독한 전자 쌍을 기증하게 만드는 반응은 298k에서 일정한 평형을 1.8 x 10^-5입니다.
암모니아 사용
암모니아의 주요 용도 중 하나는 비료의 성분입니다. 암모니아가 비료를 만들고 비료가 토양에 사용되면 밀과 같은 작물의 수율이 증가합니다. 암모니아는 또한 많은 질소 함유 화합물의 생성에 사용됩니다. 거의 모든 질소 함유 합성 화합물은 암모니아를 촉매/성분으로 사용하여 생성됩니다. 암모니아는 또한 아미노산, 페놀 히드라진 및 시안화물을 생성하는 데 사용됩니다.
암모니아는 또한 많은 가정용 세제에서 주요 성분입니다. 수산화 암모늄은 NH3가 물에 용해되어 많은 줄무늬를 남기지 않고 표면을 청소합니다. 암모니아 기반 세제는 때로 덮인 표면을 청소하는 데 효과적입니다. 암모니아의 클리너는 체중에 따라 5 ~ 10% 암모니아 어딘가에 있습니다. 약 16 ~ 25% 암모니아로 구성된 솔루션은 발효 산업에 의해 사용될 때 질소의 공급원으로서 미생물에 종종 제공됩니다. 암모니아 용액은 또한 쇠고기의 오염을 줄이기 위해 항균제로 자주 사용됩니다.