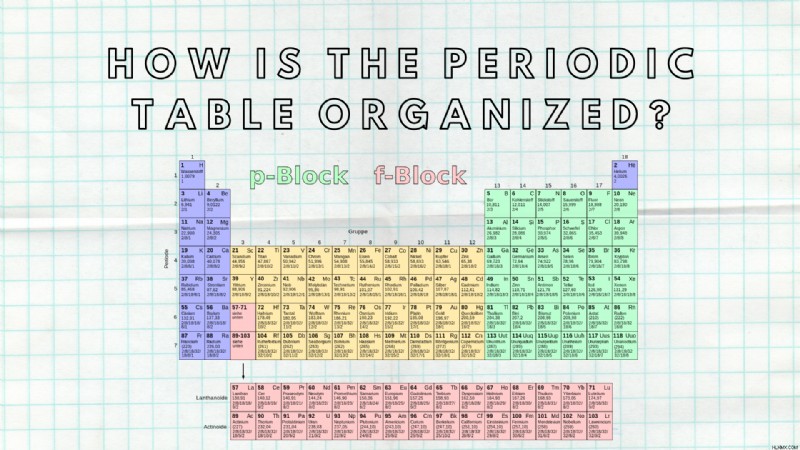
과학 학생들이 배워야하는 것 중 하나는주기적인 테이블입니다. 주기적인 테이블은 어떻게 구성되어 있습니까 ? 주기성 테이블은 그리드처럼 구성됩니다.
이 기사에서는 그리드가 요소를 어떻게 구성하는지 설명 할 것입니다. 그리드에서 요소가 어떻게 구성되어 있는지 이해하면 주기율표를 배우는 데 도움이 될 수 있습니다.
각 요소의 위치는 전혀 무작위가 아니라 원자 구조로 인한 것입니다.
그리드 구조
모든 그리드 구조와 마찬가지로 주기성 테이블에는 왼쪽에서 오른쪽으로 열과 행이 모두 있습니다. 행과 열은 정확한 특성으로 구성됩니다. 동일한 열 또는 동일한 행에있는 요소는 공통 특성을 가지고 있습니다. 예를 들어, 마그네슘 (MG)과 나트륨 (NA)은 유사한 전자 구성을 가지고 있기 때문에 몇 가지 특성을 공유합니다. 요소가 비슷한 전자 구성을 가질 때 같은 기간에 있다고합니다.
그러나 그것은 단지 행을 설명합니다. 컬럼은 유사한 화학적 특성을 갖는 요소 그룹으로 구성됩니다. 예를 들어, 칼륨 (k)과 루비듐 (RB)은 첫 번째 줄에 있습니다. 이는 그들이 같은 그룹에 있음을 의미합니다.
화학 요소는 또한 원자 수에 의해 증가하는 수로 배열됩니다.
기간
기간을 조사합시다. 결국, 그것이주기적인 테이블의 이름을 얻는 방법입니다. 왼쪽에서 오른쪽으로 각 행을 기간이라고합니다. 그것이 의미하는 바는 행의 각 요소가 다른 하나와 유사한 전자 구성을 공유한다는 점에서 다른 것입니다. 다시 말해, 같은 행의 각 요소는 정확히 같은 원자 궤도를 가지고 있습니다.
상단 행의 모든 요소를 보거나, 즉, 첫 번째 기간의 요소를 보면, 전자에 대한 원자 궤도가 하나 있음을 알 수 있습니다. 그런 다음, 두 번째 줄 또는 두 번째 기간의 요소는 전자에 2 개의 원자 궤도를 갖는 것으로 특징 지어집니다. 다른 행이나 기간마다 다른 원자 궤도를 추가해야합니다.
특정 요소에 얼마나 많은 원자 궤도가 있는지 알고 있다면 어떤 행에 있는지 알 수 있어야합니다. 그것을 보는 또 다른 방법은 주기율표에서 요소가 어떤 행을 차지하는 지 아는 경우 특정 요소가 가지고있는 원자 궤도 (1, 2, 3 등)를 알 수 있어야한다는 것입니다.
.그룹
이제 그룹을 살펴 보겠습니다. 동일한 컬럼의 모든 화학 요소 (위에서 아래로)는 동일한 그룹에 속합니다. 실제로 모든 열을 그룹이라고합니다. 그러나 요소는 어떻게“그룹화”됩니까?
각 그룹의 모든 요소는 원자가 전자라고도하는 외부 궤도에 동일한 수의 전자를 갖습니다. 이 전자는 다른 요소와의 화학적 결합에 관여하기 때문에 중요합니다.
왼쪽에서 오른쪽으로 그룹을 읽어야합니다. 첫 번째 열 또는 그룹 1의 모든 요소는 하나의 원자가 전자 (외부 쉘에 하나의 전자)를 갖습니다. 두 번째 열 또는 그룹 2의 모든 요소에는 2 개의 원자가 전자가 있습니다. 그러나 세 번째 그룹 (그룹 3)의 모든 요소에는 13 개의 밸런스 전자가 있습니다. 그때부터 18 세가 될 때까지 모든 그룹에 대해 전자를 추가해야합니다. 간단히 말해서, 기둥을 계산하면 각 요소가 외부 쉘에 얼마나 많은 전자가 있는지 알 수 있습니다. 그러나 일부 요소는 전자를 추가하는 전이 요소이기 때문에 이것에 대한 몇 가지 예외가 있습니다.
8 개의 다른 그룹이 있습니다 :
- 그룹 1은 알칼리 금속입니다 :리튬 (Li), 나트륨 (NA), 칼륨 (K), 루비듐 (RB), 세슘 (CS) 및 프랜슘 (FR).
- 그룹 2는 알칼리성 지구 금속 :베릴륨 (BE), 마그네슘 (MG), 칼슘 (CA), 스트론튬 (SR), 바륨 (BA) 및 라듐 (RA)입니다. 라듐은 방사능으로 인해 항상 지구상의 알칼리성으로 생각되는 것은 아닙니다.
- 그룹 13은 붕소 그룹입니다 :붕소 (B), 알루미늄 (AL), 갈륨 (GA), 인듐 (IN), 탈 리움 (TL) 및 때로는 비 영양 (UUT).
- 그룹 14는 탄소 그룹입니다 :탄소 (C) 실리콘 (SI), 게르마늄 (GE), 주석 (SN), 납 (PB) 및 때로는 미분류 (UUQ).
- 그룹 15는 질소 그룹입니다 :질소 (N), 인 (P), 비소 (AS), 안티몬 (SB), 비스무트 (BI) M 및 때로는 미지급 (UUP).
- 그룹 16은 산소 그룹으로도 알려진 chalcogens를위한 것입니다 :산소 (O), 황 (S), 셀레늄 (SE), 텔 루륨 (TE), 폴로늄 (PO) 및 UNUNHEXIUM (UUH).
- 그룹 17은 할로겐 (F), 염소 (CL), 브로민 (BR), 요오드 (I), 아스타틴 (AT) 및 때로는 미사요 (UUS)를위한 것입니다.
- Group 18은 고귀한 가스입니다 :헬륨 (HE), 네온 (NE), 아르곤 (AR), 크립톤 (KR), XEON (XE) 및 라돈 (RA).
이들 그룹 각각은 훨씬 더 자세하게 연구 할 수있는 속성을 공유했지만 주기율표가 어떻게 구성되는지 확인하기 위해 알 필요는 없습니다.
상단의 두 요소
수소 (H)와 헬륨 (HE)이 맨 위에있는 요소에 대해 궁금 할 것입니다. 이 두 가지는 다른 이유로 특별한 요소입니다.
수소 (H)는 중성 형태의 단일 중성자가 없으며 하나의 양성자 및 하나의 전자 만 갖지 않습니다. 이제 외부 껍질을 채우기 위해 원자 수소를 다른 요소와 결합해야합니다.
헬륨 (HE)은 모든 요소 중에서 독특합니다. 원자가 쉘이라고도하는 외부 궤도에 두 개의 전자 만 있습니다. 다른 모든 고귀한 가스 (그룹 18)는 외부 궤도 또는 원자가 쉘에 8 개의 전자를 갖습니다. 그렇다면 왜 Neon (NE), Argon (AR), Krypton (KR), Xenon (XE) 및 Radon (RA)이있는 헬륨 그룹은 왜입니까? 그들은 모두 공통점이 있기 때문에 :각각의 원자가 껍질이 가득 차 있습니다.
이것은주기적인 테이블이 구성되는 방식입니다. 요소의 각각의 위치가 특성을 이해하는 데 유용하다는 것을 이해합니다. 주기적인 테이블을 외우려고하거나 과학 그룹의 일부로 요소를 연구 해야하는 경우 요소의 위치가 무작위가 아니지만 매우 긴밀한 논리를 따르는 학문적 노력에 도움이 될 수 있음을 알고 있습니다.