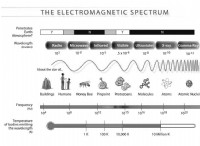
Hund의 첫 번째 규칙에 따라, 가장 낮은 에너지 원자 상태는 개방 서브 쉘에서 전자의 전체 스핀 양자 수를 최대화하는 것입니다. 이중 점령 전에, 서브 쉘의 궤도는 각각 평행 스핀의 전자로 단독으로 점유된다. (이것은 때때로“버스 좌석 규칙”이라고도합니다. 이는 버스 승객의 행동과 유사하기 때문에 이중 점유가 발생하기 전에 개별적으로 모든 이중 좌석을 채우는 경향이 있기 때문입니다.)
헌드의 규칙
- Hund의 규칙에 따르면, 총 스핀 상태가 높은 원자가 때때로 더 안정적입니다. 흥분된 전자 구성의 상태를 결정하기 위해이 규칙은 상당히 신뢰할 수 있습니다 (몇 가지 예외가 있음). Friedrich Hund는 1925 년에 그것을 발견했습니다. Hund의 규칙은 다음과 같습니다. Sublevel의 궤도가 이중 점유되기 전에 각 궤도는 개별적으로 점유됩니다. 별도로 점유 된 궤도의 각 전자는 동일한 스핀을 갖습니다 (총 스핀을 최대화하기 위해). 최대의 다중 규칙은 헌드의 규칙의 또 다른 이름입니다.
- 전자는 첫 번째 규칙에 따라 파트너가되기 전에 항상 빈 궤도에 들어가야합니다. 다른 전자와 궤도를 공유하는 대신 전자는 반발을 줄이기 위해 자체적으로 점유합니다. 양자 기계 시뮬레이션에 따르면 단독으로 점유 된 궤도의 전자는 핵으로부터 덜 효율적으로 보호됩니다.
- 두 번째 규칙은 짝을 이루지 않은 단독으로 점유 된 궤도의 전자가 같은 수의 스핀을 가지고 있음을 나타냅니다. SUBLEVEL의 첫 번째 전자는 "스핀 업"또는 "스핀 다운"할 수 있습니다. Sublevel에서 첫 번째 전자의 스핀이 결정되면, 그 하위 벨의 다른 모든 전자의 스핀은 첫 번째 스핀에 의해 결정됩니다. .
헌드의 규칙에 대한 설명
- 원자는 전자가 별개의 에너지 궤도에서 공개하는 핵으로 구성됩니다. Aufbau 원리는 전자가 먼저 더 높은 에너지 수준을 채우기 전에 가장 낮은 에너지 수준을 채우는 것으로 나타났습니다. 결과적으로, 전자는 별도의 원자 궤도에 위치하여 전자 구성을 형성한다. 반면에 헌드의 규칙으로 알려진 일련의 규칙에 따라 궤도의 충전. 페어링 된 전자와 무제한 전자는 다른 특성을 가지기 때문에 Hund의 규칙은 원자 특성을 예상하는 데 도움이 될 수 있습니다 (특히 자기장과의 상호 작용).
- 원자가 서로 접촉하면 외부 전자 또는 원자가 껍질이 먼저 상호 작용합니다. 관련 Atom의 원자가 쉘이 가득 차 있지 않으면 가장 안정적이며 가장 반응성이 높습니다. 동점 요소의 화학적 거동은 주로 원자가 전자에 의해 결정됩니다. 화학적 특성은 일반적으로 동등한 범위의 원자가 전자를 가진 부품들 사이에서 유사합니다. 모든 동점 원자의 궤도가 전자로 채워지면 가장 안정적 (따라서 반응하지 않음). 매우 안정적이고 일반적으로 서로 반응하지 않는 고귀한 가스는 이러한 구성을 가지고 있습니다.
헌드의 규칙 노트
원자의 서브 쉘에서 전자의 충전은 Hund의 최대 다중 규칙에 의해 처리됩니다. 동일한 에너지 궤도로 서브 쉘의 이상을 줄임으로써 전체 전자 구성을 결정하는 데 도움이됩니다. 헌드의 규칙은 동일한 서브 쉘의 궤도를 채우는 전자가 동일한 기준을 따른다 고 말합니다. 원자 수준에서지면 상태 다중 전자를 결정하는 Hund의 규칙은 상관 물리학의 초석 중 하나입니다. 전자가 실제 시스템에서 원자 사이를 뛰어 다니면, 이들은 밴드 이론으로 일반적으로 표현되는 여정을 얻습니다. 상관 관계 이론의 목표는 두 극단 사이의 상태를 특성화하기위한 신뢰할 수있는 접근법을 제공하는 것입니다.
헌드의 규칙 및 전자 구성
- aufbau 원칙, 헌드의 규칙 및 Pauli 배제 원칙은 주기율표에서 원자의 전체 전자 배열을 조절하는 세 가지 필수 규칙입니다.
- aufbau 규칙은 가장 낮은 에너지 궤도가 먼저 채워질 것을 지시합니다.
- Pauli 배제 규칙에 따르면, 궤도의 두 전자는 같은 스핀을 가질 수 없습니다.
- 헌드의 규칙은 퇴화 궤도라고 불리는 동일한 서브 쉘에 속하는 궤도의 전기적 배열과 관련이 있습니다.
Hund의 규칙 응용
- 양자 화학에서 헌드의 규칙은 매우 중요합니다. 그것은 동일한 서브 쉘의 퇴화 궤도의 안정성을 보여줍니다.
- 분광학에서 Hund의 규칙은 요소의 원자 스펙트럼을 구성하는 데 사용됩니다.
- 헌드의 규칙은 최대 스핀 다중성을 보장하여 안정적인 전자 배열을 결정하는 데 도움이됩니다.
결론
Hund의 최대 다중 규칙은 서브 쉘 궤도에서 전자를 구성하는 메커니즘을 제공합니다. Aufbau 규칙은 서브 쉘의 에너지 수준을 기반으로하며, 먼저 어떤 서브 쉘을 채워야하는지 결정합니다. 각 서브 쉘 (S, P, D, F)의 궤도 수는 다릅니다. Hund의 규칙은 동일한 서브 쉘의 궤도를 채우는 전자가 기준을 따른다는 것을 명시합니다. Hund의 규칙에 따르면 둘 이상의 퇴화 (즉, 동일한 에너지) 궤도가 이용 가능하면 한 전자가 짝을 이루기 전에 모두 절반이 가득 찰 때까지 각각에 전자가 들어갑니다. Pauli 배제 원칙에 따라 두 개의 전자가 동일한 양자 수 세트로 식별 될 수 없습니다.