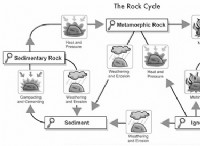
이것은 운동 에너지 방정식에서 볼 수 있습니다.
$$ ke =\ frac {1} {2} mv^2 $$
어디:
- \ (ke \)는 운동 에너지입니다
- \ (m \)는 질량입니다
- \ (v \)는 속도입니다
주어진 온도에서 분자의 평균 운동 에너지는 일정합니다.
$$ \ 오버 라인 {ke} =\ frac {3} {2} k_b t $$
어디:
- \ (\ Overline {ke} \)는 평균 운동 에너지입니다
- \ (k_b \)는 Boltzmann 상수입니다
- \ (t \)는 온도입니다
이것은 질량이 큰 분자가 더 작은 질량을 가진 분자보다 평균적으로 더 낮은 속도를 가져야 함을 의미합니다.
예를 들어, 실온에서, 질소 분자 (N2)는 초당 평균 속도가 약 515 미터이며 산소 분자 (O2)의 평균 속도는 초당 약 460 미터입니다. 이것은 질소 분자가 산소 분자보다 가볍기 때문에 평균 운동 에너지가 더 높기 때문입니다.
질량에 대한 속도의 의존성은 또한 분자의 뿌리 평균 제곱 (RMS) 속도에서 볼 수 있습니다.
$$ v_ {rms} =\ sqrt {\ frac {3 k_b t} {m}} $$
어디:
- \ (v_ {rms} \)는 루트 평균 제곱 속도입니다
- \ (k_b \)는 Boltzmann 상수입니다
- \ (t \)는 온도입니다
- \ (m \)는 질량입니다
이 방정식은 분자의 RMS 속도가 질량의 제곱근에 반비례한다는 것을 보여줍니다. 이것은 질량이 큰 분자가 더 작은 질량을 가진 분자보다 평균적으로 RMS 속도가 낮다는 것을 의미합니다.