물은 액체 형태보다 얼어 붙은 형태 인 얼음으로 밀도가 낮습니다. 이는 얼음의 분자가 액체 물의 분자보다 더 떨어져 있기 때문입니다. 얼음의 분자는 산소와 수소 원자 사이의 수소 결합에 의해 더 멀리 떨어져 있습니다.
거대한 빙산에서 작은 큐브에 이르기까지 얼음 (얼어 붙은 물)은 항상 액체 형태로 떠 다니고 있습니다. 그렇게 이상하지 않습니까?
우리는 그것이 비정상적이라고 생각하는 유일한 사람은 아닙니다. 전 세계는 고체가 액체 형태로 떠 다니는 것이 놀랍습니다. 빠른 Google 검색을 수행하면 얼음의 퀴어 경향에 대해 논의하는 수십 페이지를 찾을 수 있습니다.
다른 모든 것들과 마찬가지로,이 현상의 과학적 이유가 있습니다. 하지만 먼저 물건을 가라 앉히거나 부유하게 만드는 것에 대해 명확하게합시다.
물체가 물 (또는 다른 액체)에 떠 다니는 능력에 관해서는 단일 경험 규칙은 해당 물체의 밀도와 관련이 있습니다. Archimedes의 원칙에 대해 들어 본 적이 있습니까?
Archimedes의 원칙 물체가 물에 떠 다니려면 같은 양의 물을 대체해야한다고 말합니다. 다시 말해, 물 한 몸에있는 물체의 운명은 Archimedes의 원리에 의해 결정된다고 말할 수 있습니다.
단단한 물체가 액체 대응 물보다 밀도가 더 많다는 것은 상식입니다. 화학적으로 이것은 또한 의미가 있습니다. 분자는 고체로 잘 정의 된 방식으로 서로 더 밀접하게 결합되어 단단하고 더 많은 무게를줍니다. 우리가 일상 생활에서보고 관찰하는 모든 일반적인 물질은이 기본 원리를 따릅니다. 단단한 물체는 더 밀도가 높고 액체보다 무게가 더 많습니다.
그 점을 감안할 때, 얼음은 왜 단단한 일 - 물에 떠 다니는가? 일반 대회에 따르면 밀도가 더 많아서도 가라 앉지 않아야합니까?
작은 물 정보
물은 훌륭한 액체이며 비정상적인 행동과 화학 구조로 가득 차 있기 때문에 액체 형태에 떠 다니는 고체의 일반적인 행동에 흥미로운 예외를 제시합니다.
.액체를 계속 냉각 시키면 밀도가 고체가 될 때까지 밀도가 계속 증가하고 최대 밀도를 얻습니다. 그러나 물의 경우이 추세는 약간 다르며, 이는이 전체 논의의 근본 원인입니다.
물의 밀도가 계속 냉각 될수록 증가합니다. 그러나 얼어 붙을 때 밀도가 가장 높은 다른 액체에 반대하는 물은 온도가 섭씨 4도 (화씨 39.2도)에 도달하면 최대 밀도를 달성합니다.
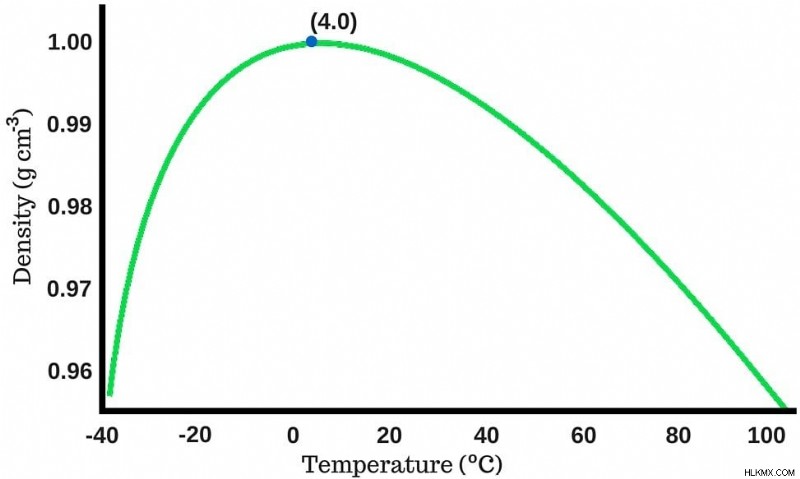
밀도가 변화하는 온도
에 따라 어떻게 다른지를 보여주는 그래프섭씨 4도를지나 물을 계속 식히면 밀도가 급락하기 시작합니다 (그래프에서 볼 수 있음). 0도, 즉 물이 얼음으로 변하는 온도에서 물의 밀도는 실제로 상당히 낮습니다.
얼음은 물보다 밀도가 낮고, 보관 된 액체 형태보다 밀도가 낮은 물체 (이 경우 물)가 떠 다닐 수 있습니다!
.그러나 왜 얼음의 밀도가 물보다 적은 이유는 무엇입니까?
대답하려면 물의 화학 구조를 살펴 봐야합니다.
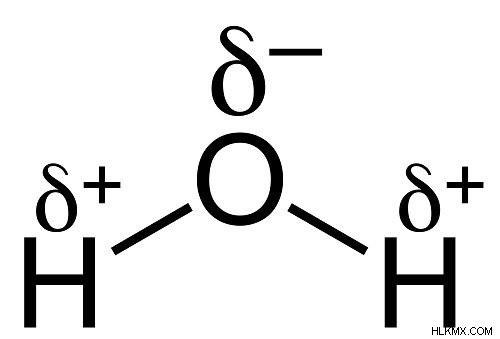
물 분자는 2 개의 수소 원자와 하나의 산소 원자로 만들어집니다
음전 차이 산소 원자는 수소 원자와 강하게 결합하여 강한 수소 결합을 형성합니다.
액체가 냉각되면 점점 더 많은 분자가 더 가까워지고 작은 영역에서 수용해야합니다. 이것은 대부분의 고체에 액체 형태보다 밀도가 높습니다. 그러나, 물의 경우, 음으로 차지 된 산소 원자는 얼음이 더 밀도가되지 않도록 서로 (더 작은 공간에서 모일 때) 서로 격퇴한다. 이것이 온도가 섭씨 4도 아래로 계속 떨어지면 밀도가 실제로 감소하는 이유입니다.







