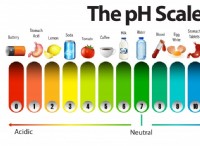
pH는 용액에서 수소 이온의 양을 측정한다. 기본 용액은 농도의 수소 이온을 갖는 반면, 산성 용액은 고농도의 수소 이온을 갖는다. 용액의 pH는 산과 염기를 첨가하여 변경 될 수 있습니다. 산은 pH를 낮추고 염기는 pH를 증가시킨다. 산을 물과 맹목적으로 섞으면 올바른 양을 추가 할 가능성이 없습니다. 너무 많은 산을 용액에 넣으면 Base를 사용하여 pH를 다시 한 번 올려야합니다. 산과 염기를 낭비하지 않으려면 간단한 계산을 사용하여 정확히 얼마나 필요한지를 결정하십시오.
.하이드로 클로르 산, 수경 산 및 질산과 같은 강산을 각각 지정된 HCl, HBR 및 HNO_3을 얻습니다. 강산은 매우 높은 농도의 수소 이온을 가지고 있습니다. 수소 이온은 용액을 산성으로 만듭니다. 수산화물 이온은 용액을 기본으로 만듭니다.
강산에서 몰로라고도하는 수소 이온의 농도를 얻습니다. 농도가 없다면 용액의 pH가있을 수 있습니다. pH가있는 경우 다음 방정식을 사용하여 pH에서 Molarity로 변환합니다.
Molarity =10^-[pH]
숫자가 1보다 높으면 오류가 발생했을 것입니다. 그러나 산이 매우 강한 경우 PH는 0보다 작고 1보다 농도를 생성 할 수 있습니다.이 결과 값은 용액의 몰계입니다. 몰토리티는 용액의 리터당 산의 두더지의 양입니다. 예를 들어, 용액이 0.5 몰이 있으면 1 L 당 0.5 mol의 산만 있습니다.이 공식을 사용하여 어금니를 계산합니다.
Molarity =산의 두더지 용액의 용액
동일한 방법을 사용하여 물 샘플의 몰토리성을 찾으십시오.
이전 단계에서 방정식을 사용하여 대상 pH 값을 어금니로 변환합니다.
목표 값의 pH 수준을 얻는 데 필요한 산의 양을 계산하십시오. 다음 공식을 사용하여 이것을 해결하십시오.
m_1v_1 + m_2v_2 =m_3 (v_1 + v_2)
이 방정식에서, "M_1"은 산의 몰라리, "V_1"은 산성 용액의 부피, "M_2"는 물의 몰라도이고 "V_2"는 물의 부피입니다. 이 방정식을 "V_1"을 해결하도록 변환하면 다음 방정식이 생성됩니다.
v_1 =(m_3v_2 - m_2v_2)/(m_1 - m_3).