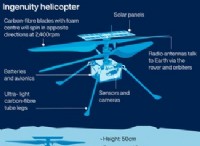
수소 연소 :
* 과정 : 수소와 산소와의 빠른 반응, 물을 생산하고 열과 빛을 방출합니다. 이것은 발열 화학 반응입니다.
* 조건 : 연쇄 반응을 시작하기 위해 충분한 산소 공급과 점화 (열)가 필요합니다.
* 온도 : 상대적으로 낮은 온도에서 발생합니다 (별과 비교).
* 에너지 방출 : 화학 결합의 파괴 및 형성을 통해 에너지를 방출합니다.
항성 반응 (핵 융합) :
* 과정 : 헬륨 핵을 형성하기 위해 원자 핵 (주로 수소 핵) (양성자)의 융합을 포함한다. 이 과정은 화학 반응보다 훨씬 큰 양의 에너지를 방출합니다.
* 조건 : 매우 높은 온도 (섭씨 수백만도)와 별의 코어에서 발견되는 압력이 필요합니다.
* 에너지 방출 : 아인슈타인의 유명한 방정식 E =MC²에 의해 설명 된 바와 같이, 소량의 질량을 에너지로 전환하여 에너지가 방출됩니다.
* 부산물 : 핵 융합은 헬륨뿐만 아니라 다른 원소를 생성하여 수소와 헬륨보다 무거운 원소의 우주 풍부에 기여합니다.
주요 차이점 :
1. 에너지 소스 : 수소 연소는 화학 에너지에 의존하는 반면, 항성 융합은 원자력에 의존합니다.
2. 온도 : 항성 융합은 섭씨 수백만도를 필요로하며 수소 연소는 훨씬 낮은 온도에서 발생합니다.
3. 반응 메커니즘 : 수소 연소는 화학 결합의 파괴 및 형성을 포함하는 반면, 핵 융합은 원자 핵의 병합을 포함한다.
4. 에너지 스케일 : 핵 융합은 화학 반응보다 몇 배 더 많은 에너지를 방출합니다.
5. 요소 형성 : 핵 융합은 더 무거운 원소의 생성을 담당하는 반면, 수소 연소는 그렇지 않습니다.
요약 : 두 과정 모두 수소가 포함되지만 기본 메커니즘, 에너지 원 및 조건은 근본적으로 다릅니다. 수소 연소는 지구상에서 친숙한 현상이며, 핵 융합은 별을 강화하고 우리 주변에서 볼 수있는 요소를 만드는 과정입니다.