올해, 생리학 또는 의학 및 화학 분야의 노벨상은 각각주기 시계 연구와 냉동 전자 현미경 (Cryo-EM)의 발전을 연구하는 연구원들에게 갔다. 거의 논평을 불러 일으키지 않은 것은이 분야가 겉보기에 이질적으로 교차했다는 것입니다. Cryo-EM은 일주기 시계를 담당하는 단백질에 대한 연구를 추진하기위한 가장 중요한 도구 중 하나가되었습니다.
수십 년 전에주기 시계를 발견 한 연구원들은 수준이 태양과 동기화되어 세포 내부가 상승하고 떨어지는 단백질을 발견했습니다. 이 단백질은 이제 게놈의 광대 한 늪의 발현을 조절하는 다른 사람들과 복잡한 것을 형성합니다. 이러한 복합체는 과일 파리 및 사람과 같은 다양한 유기체의 몸의 거의 모든 세포에 존재합니다. 시아 노 박테리아에는 자전거 단백질 그룹도 있습니다. 이 단백질 시계는 밤낮으로 생리학을 유지하여 유기체가 적시에 먹고 세포에 적시에 나뉘어지고 물론 적시에 잠을 자도록 지시합니다. 연구원의 발견은 지구의 삶의 핵심에서 리듬을 드러내는 분야를 시작하는 데 도움이되었습니다.
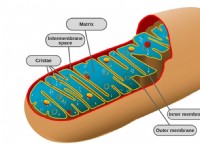
한편, 화학 연구원들은 1931 년에 전자 현미경이 발명되었을 때 대부분의 사람들이 가능하다고 생각했던 것 이상의 가시성 임계 값을 훨씬 더 밀어 넣었습니다. 전자 현미경에서, 얇은 조직 조각은 금속으로 코팅 된 다음 전자 빔으로 스캔됩니다. 뒤로 튀는 전자는 민감한 검출기에 의해 픽업됩니다. 그런 다음 연구원들은 처리 된 신호에서 세포 내부의 이미지를 생성합니다. 전통적인 형태의 전자 현미경을 사용하여, 개별 미토콘드리아의 주름진 내부 인 세포의 기계류, 리보솜의 검은 색 불꽃이 초점을 맞 춥니 다.
그런 다음 다른 혁신 중에서도 현미경 연구자들은 샘플을 냉동시키는 것이 그 어느 때보 다 높은 해상도 이미징을 허용 할 것이며, 별도의 단백질의 이미지가 계산적으로 결합되어 구조적 모델을 개발할 수 있음을 깨달았습니다. 결과적으로, 이제 개별 단백질을 해결할 수 있습니다. 어떤 경우에는 원자까지도.
노벨 화학상이 발표되는 동안, 공무원들이 화면에서 번쩍이는 Cryo-EM 이미지 중 하나는 기술의 힘을 설명하기 위해 스크린에서 번쩍였다. 최근 네덜란드 위트레흐트 대학교의 구조 생물학자인 Albert Heck는 최근 Science 의 구조를 발표했습니다. 그의 동료들과 함께, 그레이프 바인을 통해 영광의 순간에 대해 듣고 기뻤습니다. "우리에게는 그것이 완전히 놀라운 일이었다"고 그는 말했다. 그러나 공간적 배열이 여전히 불분명 한 단백질의 클러스터 인 일주기 시계의 구조를 이해하는 것은 Cryo-Em이 좋은 종류의 것입니다.
.단백질의 3-D 형태를 추론하기위한 다른 기술은 시계 복합체를 실격시키는 엄격한 요구 사항을 가지고 있습니다. 예를 들어, 관심있는 단백질에서 방사선을 튀는 결정학은 단백질이 결정화해야한다. 수천 개의 단백질 분자 사본을 수집하여 샘플에 압축 할 수 있더라도 많은 단백질은 깔끔한 결정 구조로 정렬되지 않습니다. 또 다른 구조적 생물학 도구 인 핵 자기 공명 영상은 매우 작은 단백질이나 단백질의 일부만 보는 데 좋습니다. Cryo-EM을 사용하면 많은 재료가 필요하지 않으며 크리스탈이 필요하지 않으며 크기는 장애물이 아닙니다. Heck은“더 큰 크기는 Cryo-EM에 이상적이며 거의 더 많을수록 더 좋습니다.
더욱이, 이러한 다른 기술은 단백질을 살아있는 세포의 위치와 구성의 맥락에서 벗어나게합니다. 이러한 한계는 일반적으로 민감하고 변하기 쉬운 단백질에 대해 우리가 가장 알고 싶은 것을 배우는 능력을 약화시킵니다.
Cryo-EM을 사용하여 시아 노 박테리아 시계로 만든 이미지와 그의 동료들은 서로 섬세하게 잡는 단백질의 트리오를 보여줍니다. 그들은 시간이 지남에 따라 얼어 붙었습니다. 그러나 팀이 아직 캡처하지 않은 더 많은 구성이 있다고 Heck은 말했다. 이것은 일주기 시계의 아름다움이며, 사진을 얻는 데 어려움 중 하나입니다. 시간이 지남에 따라 변형됩니다. 3 개의 시아 노 박테리아 시계 단백질은 시간에 따라 다른 비율로 함께 결합합니다. 때로는 하나의 단백질 중 4 개, 다른 하나 중 6 개, 세 번째 중 10 개 또는 수많은 다른 순열입니다. 팀은 샘플을 명확한 이미지를 얻기 위해 샘플을 순열 중 하나로 신중하게 제한해야했기 때문에 Cryo-EM 프로세스가 복잡해졌습니다. 그러나 그들은 그것을했다.
단백질이 훨씬 더 많은 포유 동물 시계의 이미지를 생성하는 것은 매우 까다로울 수 있다고 Heck은 말했다. 시아 노 박테리아의 단순한 시계조차도 6 년의 노동이었습니다.
그럼에도 불구하고 9 월에 신경 생물 학자 Charles Weitz와 Harvard Medical School의 동료들은 포유 동물 시계 단지에 전자 현미경을 사용한 연구를 발표했습니다. 그것은 그 복합체의 표면의 화려한 이미지를 드러 냈지만, Cryo-Em이 결국 달성 할 수있는 그림자 일뿐입니다. Weitz가 이메일에서 설명했듯이 Cryo-EM의 경우, "성공적인 결과는 외부 윤곽 만 아닌 내부 구조뿐만 아니라 입자의 높은 해상도를 모두 제공 할 것입니다." 전자 현미경이 얼마나 많은 양이 발전했는지를 감안할 때, 한때는 도달 할 수 없었던 연구 목표입니다.