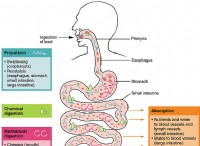
1. 효소 구조 :
* 활성 사이트 : 효소는 활성 부위라고하는 영역을 갖는 특정 3 차원 모양을 갖는다. 이 사이트는 특정 기질 분자에 결합하도록 설계되었습니다.
* 잠금 및 키 모델 : 활성 부위와 기판은 자물쇠와 키처럼 함께 맞습니다. 이 정확한 적합은 올바른 기질 만 효소에 결합 할 수 있도록합니다.
* 유도 적합 모델 : 보다 현대적인 견해는 효소의 활성 부위가 기질을 수용하기 위해 모양을 약간 변화시켜 착용감을 향상시킬 수 있음을 시사합니다.
2. 기판 결합 :
* 비공유 상호 작용 : 효소 및 기질은 다음과 같은 약한 비공유 상호 작용을 통해 결합합니다.
* 수소 결합 : 극 그룹 사이의 형태.
* 이온 결합 : 반대로 청구 된 그룹 사이의 형태.
* van der waals 세력 : 모든 분자 사이의 약한 매력.
* 소수성 상호 작용 : 비극성 그룹 간의 상호 작용.
3. 효소--스트레이트 복합체의 형성 :
* 효소의 활성 부위와 기질 사이의 상호 작용은 효소-하류 복합체를 생성한다.
*이 단지는 일시적이며 짧은 기간 동안 만 존재합니다.
* 반응이 발생하기 위해 기판을 올바른 배향으로 가져옵니다.
4. 촉매 :
* 복합체가 형성되면 효소는 화학 반응을 용이하게한다.
* 효소는 반응의 활성화 에너지를 낮추어 더 빨리 진행합니다.
* 효소는 반응의 평형을 변화시키지 않습니다. 평형에 도달하는 속도 만 속도를 높입니다.
요약 :
효소--스트레이트 복합체는 효소의 활성 부위와 기질 사이의 특이 적 맞춤으로 인해 형성된다. 이 결합은 약하고 비공유 상호 작용에 의해 촉진된다. 복잡한 형성은 효소가 반응을 촉매하기위한 올바른 배향으로 기질을 가져 오는 데 중요하다.