버퍼 용량은 내성의 측정입니다. 특정 용액은 산 또는 염기가 추가 될 때 pH의 변화에 저항력이 있습니다.
고등학교 화학을 기억하거나 화학 101과 같은 대학 과정을 수강 한 경우 적정 테스트를 수행하게됩니다. 개인적으로, 처음으로, 유리 플라스크의 바닥에 액체가 퍼질되면, 핑크색이나 마젠타의 색조로 바뀌기 위해 해결책이 참을성있게 기다렸다가 솔직히 과학자처럼 느껴졌습니다! 그러나 왜이 솔루션이 일정량의 화학 물질을 추가 할 때만 색상이 변하는가? 그 대답을 얻으려면 솔루션의 고유 한 속성을 이해해야합니다.
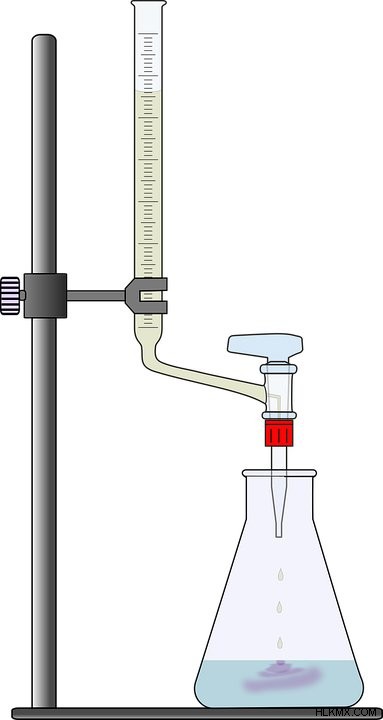
(이미지 크레딧 :Pixabay)
버퍼 용량 :정의
버퍼 용량이 무엇인지에 들어가기 전에 먼저 버퍼를 이해해야합니다. 버퍼 제한된 양의 산 또는 염기가 첨가 될 때 pH의 변화에 저항하는 화합물입니다. 완충 용액의 화학적 조성은 일반적으로 약한 산 또는 약한 염기를 수반한다.
.
이제 버퍼 용량 pH의 변화에 저항하는 완충액의 효율의 척도로 정의 될 수있다. 이 정의는‘중요한 변화는 무엇입니까?’에 대해 약간의 문제를 제기합니다. 때로는 1 단위의 변화가 중대한 변화를 가져 오지 않습니다. 다른 경우에는 0.1 단위 변화조차도 큰 차이를 일으킬 수 있습니다. 따라서보다 명확한 정의를 제공하기 위해, 완충 용량은 강한 산 또는 강한 염기의 양으로 정의 될 수 있으며, 이는 1 리터의 솔루션에 추가되어 하나의 pH 단위에 의해이를 변경해야합니다. 버퍼 용량 방정식은 다음과 같습니다. 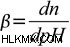 여기서 n은 강력한 기본의 일부 (솔루션 1 L 당)입니다. N 몰의 산을 첨가하면 pH를 동일한 값만큼이나 반대 방향으로 바꿀 것입니다. PH, PKA 및 버퍼 농도와 완충 용량을 연결하는 공식을 도출합니다.
여기서 n은 강력한 기본의 일부 (솔루션 1 L 당)입니다. N 몰의 산을 첨가하면 pH를 동일한 값만큼이나 반대 방향으로 바꿀 것입니다. PH, PKA 및 버퍼 농도와 완충 용량을 연결하는 공식을 도출합니다.
버퍼 용량 계산
이제 버퍼 방정식이 어떻게 작성 될 수 있는지 보았으므로 위의 방정식에 도달하는 방법을 더 잘 이해하기 위해이를 도출 해 보겠습니다. 이 도출을 조금 더 쉽게하기 위해, 우리는베이스 모노 프 로컬 (하나의 양성자 만 받아들이는베이스)을 만들 것입니다. 우리는 또한 부피가 하나라고 가정합니다. 이것은 농도와 두더지의 수를 상호 교환 적으로 치료하는 데 도움이되기 때문입니다. 우리가 가정하는 솔루션의 전하 균형은 다음 방정식으로 입증됩니다.
[a -]+[OH+] =[b+]+[h+]
[B+]는 용액에서 강한 염기 농도의 존재를 나타냅니다. [b+]는 또한 n 입니다 첫 번째 버퍼 용량 방정식에 존재합니다. 이제 완충액의 총 농도는 다음 방정식에 의해 주어집니다.
cbuff =[ha]+[a -]
상기 방정식에서 [ah]는 더 작은 구성 요소로 분해 될 수 있습니다. 더 크고 더 복잡한 화합물을 작은 기본 요소로 분해하는 것은 해리 상수로 알려져 있습니다. 해리 상수는 유도를보다 쉽게 단순화하는 데 도움이됩니다. 아래 방정식의 KA는 산 해리 상수입니다. 분자가 산으로 얼마나 쉽게 작용하는지와 관련이 있습니다.
[ha] =([h+] [a -])/ka
이제 위의 방정식은 버퍼 농축 방정식으로 대체 될 수 있으며 다음 방정식을 제공합니다.
cbuff =([h +] [a -])/ka + [a -]
이제 위의 방정식을 단순화하기 위해 [A-]를 공통 요소로 받아들이려면 다음 방정식을 얻을 수 있습니다.
[A -] =(CBUFF+KA)/(ka+h+)
앞으로 나아 가기 전에, 우리는 Water Ionization Constant 로 알려진이 파생물을 깔끔하게 포장하기위한 전제 조건으로 사용될 중요한 정의를 이해해야합니다. 또는 물의 자체 이온화 . 물의 자체 이온화 순수한 물 또는 수용액에서 발생하는 이온화 반응으로, H2O는 수소 원자 중 하나의 핵을 잃어 수산화물 이온, Oh -.
가되었다.

(사진 크레딧 :Manuel Almagro Rivas/Wikimedia Commons)
이제 전하 밸런스 방정식, [a–] 등가 및 물 이온화 상수를 사용하여 다음 방정식으로 올 수 있습니다.
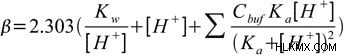 방정식에 존재하는 첫 두 항은 솔루션의 버퍼에 의존하지 않습니다. 그들은 높은 (또는 낮은) pH의 용액이 pH 변화에 내성이라는 사실을 나타냅니다. 이는 PH의 사지가있는 특정 솔루션이 완충액이 존재하지 않더라도 변화에 내성이 있음을 나타냅니다.
방정식에 존재하는 첫 두 항은 솔루션의 버퍼에 의존하지 않습니다. 그들은 높은 (또는 낮은) pH의 용액이 pH 변화에 내성이라는 사실을 나타냅니다. 이는 PH의 사지가있는 특정 솔루션이 완충액이 존재하지 않더라도 변화에 내성이 있음을 나타냅니다.
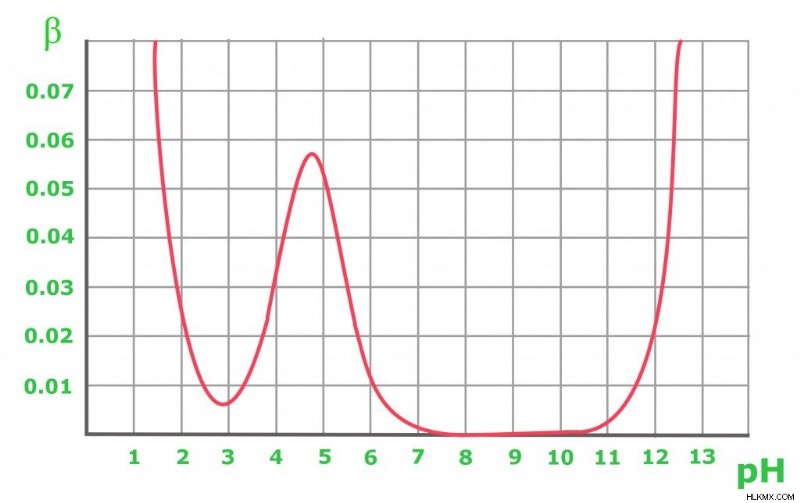 위의 그래프는 Acetic 버퍼의 0.1m의 버퍼 용량 변경을 보여줍니다. 예상 한 바와 같이, 완충액은 산 및 기본 첨가물을 저항하여 등몰 용액 (pH =PKA)을 유지한다. 그래프로부터, 버퍼 용량은 PKA 값에 가까운 pH에 대해서만 합리적으로 높은 값을 갖는다는 것이 명백하다. pH 8-10의 컨쥬 게이트 염기를 함유하는 솔루션은 0의 완충 용량을 가지며, 더 높은 pH의 경우 강한베이스의 존재가 중요한 역할을 시작합니다. pH 3 미만의 순수한 아세트산 용액의 경우, pH는 고농도의 H+ 양이온으로 인해 변화에 내성이있을 정도로 이미 낮다.
위의 그래프는 Acetic 버퍼의 0.1m의 버퍼 용량 변경을 보여줍니다. 예상 한 바와 같이, 완충액은 산 및 기본 첨가물을 저항하여 등몰 용액 (pH =PKA)을 유지한다. 그래프로부터, 버퍼 용량은 PKA 값에 가까운 pH에 대해서만 합리적으로 높은 값을 갖는다는 것이 명백하다. pH 8-10의 컨쥬 게이트 염기를 함유하는 솔루션은 0의 완충 용량을 가지며, 더 높은 pH의 경우 강한베이스의 존재가 중요한 역할을 시작합니다. pH 3 미만의 순수한 아세트산 용액의 경우, pH는 고농도의 H+ 양이온으로 인해 변화에 내성이있을 정도로 이미 낮다.