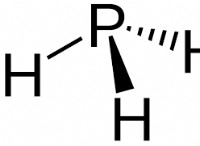
그램을 두더지로 변환하려면 화합물의 분자 질량을 찾고 화합물의 그램 수를 분자 질량으로 나누어야합니다.
.
그램을 두더지로 변환하려면 2 단계가 포함됩니다.
1 단계 :화합물의 분자 질량을 찾으십시오.
2 단계 :화합물의 그램 수를 분자 질량으로 나눕니다.
주어진 화합물의 두더지의 수를 결정하기 위해, 가장 먼저해야 할 일은 해당 화합물의 분자 질량 (또는 분자량)을 찾는 것입니다. 이 작업을 마치면 화합물의 무게가 물리적으로 (그램으로) 양을 결정해야합니다. 이 두 값을 모두 얻은 후에는 화합물의 물리적 중량을 분자량으로 나누어야합니다.
Moles 전환 계산 절차에 그램을 더 깊이 파고 들기 전에 기본 사항을 빠르게 요약하겠습니다.
화학의 두더지는 무엇입니까?
물질의 두더지는 정확히 12 그램의 카본 -12에 원자가있는 것과 동일한 수의 기본 단위를 함유하는 물질의 질량으로 정의됩니다. 이는 약 6.022 x 1023 원자입니다.
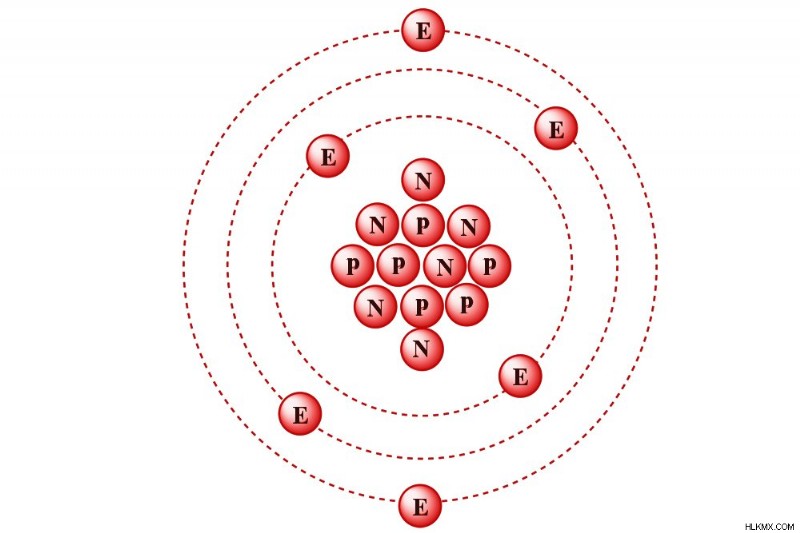
Carbon-12는 핵이 6 개의 양성자와 6 개의 중성자를 함유 한 탄소 동위 원소입니다.
나는 또한 두더지 (화학)의 더 쉽고 단순한 이해 정의를 진술하고 싶습니다.
두더지는 화합물의 측정 단위입니다. 거리, 질량, 시간 등과 같은 물리적 수량이 측정 단위 (미터, 그램, 초)를 갖는 방식과 마찬가지로, 유사하게 화학 물질은 두더지로 측정됩니다. 요컨대,“두더지”는 화학의 양의 단위라고 말할 수 있습니다. 즉, 특정 화학 물질이 얼마나 많이 있는지 알려줍니다.
.화학의 두더지는 인체와 관련된 두더지와 혼동되어서는 안됩니다. 전자는 측정 단위이지만, 후자는 그룹에서 자란 피부 세포로 구성된 피부의 어두운 곳입니다.

화학자들이 실험실에서 화학 반응을 수행 할 때, 그들은 실제로 공정을 시작하기 전에 반응과 관련된 모든 화학 물질을 사용하고 있는지 확인하고자합니다. 센티미터 대신 광년의 은하 간 거리를 측정하는 것이 훨씬 단순하고 편리한 것처럼, 수십억과 수조로 계산하는 대신 원자를 몰로 계산하는 것이 더 쉽습니다.
.두더지에 대한 흥미로운 점은 다음과 같습니다. 모든 원소 또는 화학 물질의 1 몰은 항상 같은 수입니다. 예를 들어, 1 몰의 수소와 1 몰의 산소는 모두 약 6.022 x 1023 원자를 함유한다. 그러나 각각의 수소와 산소는 다릅니다.
화합물의 경우에도 동일하게 적용됩니다. 그들의 분자 질량이 무엇이든, 그들 모두는 특정 수의 두더지에 대해 동일한 수의 분자를 함유한다. 즉, 1 몰의 포도당은 1 몰의 메탄과 동일한 수의 분자를 함유한다. 그러나 대중은 다릅니다.
우리는 두더지가 무엇인지 이해하므로 이제 화합물에 존재하는 화합물의 물리적 무게를 이미 알고 있다면 화학 화합물에 존재하는 두더지의 수를 결정하는 방법을 살펴볼 차례입니다.
.그램으로의 몰스 전환 공식
첫 번째 단계는 다루는 화합물의 분자량 (또는 분자 질량)을 결정하는 것입니다. 화합물은 다른 원소의 다수의 원자로 구성되며, 이들의 결합 된 중량은 화합물의 분자량이된다.
이 개념을 더 잘 이해하려면 NaCl (클로라이드 나트륨 또는 일반적인 소금)의 예를 고려해 봅시다.
NaCl은 나트륨 (NA)과 클로라이드 (CL)의 두 가지 원자로 만들어집니다. 나트륨의 원자 질량은 22.98이고, 염소의 원자 질량은 35.543입니다.
NaCl의 분자 질량 =염소의 나트륨 + 원자 질량의 원자 질량
따라서, NaCl의 분자 질량은 58.52 그램/mol.
로 밝혀졌다.이것이 모든 화합물의 분자 질량을 결정할 수있는 방법입니다.
다음으로, 문제의 화합물의 '물리적'무게를 찾아야합니다.이 경우 클로라이드 나트륨입니다. 그램의 물질의 무게를 측정하는 장치 인 Analytical Balance ( "Lab Balance"라고도 함)를 사용하여 샘플의 무게를 측정 할 수 있습니다. 대부분의 화학 실험실에는 화학 물질의 무게를 측정하기 위해이 장치가 있습니다.

분석 균형 Mettler AE-260 (사진 크레딧 :US DEA/Wikimedia Commons)
이 경우, 우리는 100 그램의 일반적인 소금 샘플을 가지고 있다고 가정 해 봅시다.
화합물의 분자 질량과 물리적 중량을 모두 갖추면 간단한 공식을 사용하여 샘플에 존재하는 두더지의 수를 계산할 수 있습니다.
.몰의 수 =화합물의 중량 (그램) / 화합물의 분자량

이 예에서, NaCl의 중량은 100 그램이고, 분자량은 58.52 g/몰입니다. 따라서, NaCl의 주어진 샘플에서 두더지의 수는 1.70 몰 (100/58.52)으로 나옵니다.
또 다른 예를 들어 봅시다 - 50 그램의 물 (H2O) 샘플.
물의 분자 질량은 18 g/mol입니다.
따라서이 물 샘플의 두더지 수는 2.78 몰 (50/18)입니다.
이 공식을 사용하면 모든 화합물의 주어진 샘플에 존재하는 몰의 수를 결정할 수 있습니다.