반응에서 제한 시약 (또는 반응물)은 각 반응물에 의해 생성 된 생성물의 양을 계산하여 발견된다. 최소량의 생성물을 생산하는 반응물은 제한 반응물입니다.
유용한 제품을 산출하기 위해 화학적 반응을 위해 올바르게 진행 해야하는 많은 것들이 있습니다. 반응을 둘러싼 환경에서 존재하는 반응물의 양에 대한 환경에서. 푸른 달에서 한 번만 모든 반응물이 제품으로 전환됩니다.
대부분의 반응에서, 하나의 시약 (시약 및 반응물이 상호 교환 적으로 사용됨)이 완전히 고갈되고, 일부 양의 다른 시약은 추가 반응을 위해 이용 가능하다.
.반응물 중 하나가 항상 이용 가능한 것은 아니기 때문에 반응은 장애물에 부딪 히고 계속되지 않습니다. 완전히 사용하여 반응을 전진하는 것과 제한하는이 반응물은 제한 반응물 또는 제한 시약이라고합니다.
.

화학 반응의 제한 시약은 최종 제품의 양을 제어합니다.
반응물을 제한하는 것은 무엇입니까?
우리는 그들의 금액과 역할에 따라 반응물을 두 가지 종류로 분류합니다 : 반응물 제한 및 과도한 반응물 .
반응물을 제한하는 것은 먼저 반응에 완전히 활용되어 생산 될 생성물의 양을 제한하는 것입니다. 반면에 과도한 반응물은 반응이 정지 된 후에도 여전히 존재하는 반응물입니다.
좋아하는 베이글 공급 업체의 대기열에 서 있다고 가정 해 봅시다. 베이글 녀석은 카트에서 나와 베이글이 10 개 밖에 남지 않았다고 발표했습니다. 이제, 당신은 당신의 전화를 찾아서 줄에서 당신보다 앞서 사람들의 수를 세기 시작합니다. 당신은 총 20 명을 계산합니다.
이 예에서는 대기열에 서있는 고객과 베이글은 반응물이며, 행복한 개인 (최종 제품)을 생산하기 위해 함께 모입니다.
그러나 베이글의 수는 결국 달성 할 수있는 행복한 지급 고객의 수를 제한하여 제한 요인 (에이전트)이되며 고객은 초과 반응물로 간주됩니다.
.
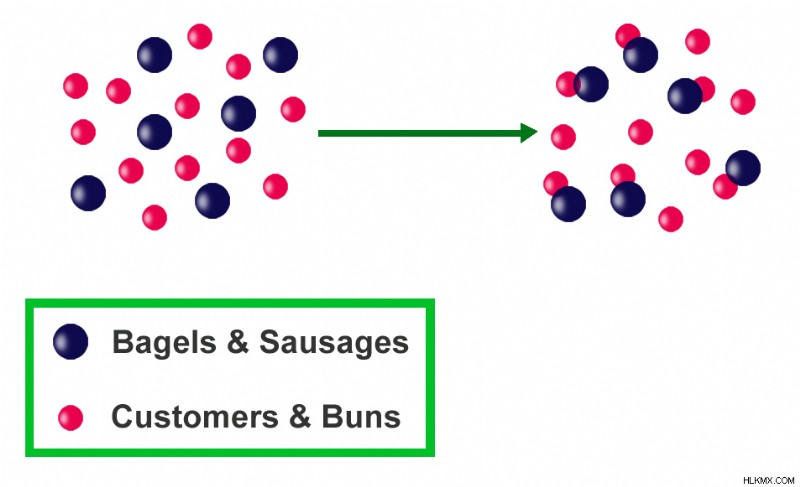
또 다른 예는 핫도그를 만드는 데 필요한 빵과 소시지의 수입니다. 핫도그를 만들려면 롤빵과 소시지가 모두 필요합니다. 불평등 한 품목 (반응물)은 부적절한 수의 핫도그 (제품)를 초래합니다. 10 개의 빵과 5 개의 소시지를 사용하면 5 개의 핫도그 만 생산할 수 있으며 5 개의 빵이 남아있을 것입니다. 빵은 초과 할 수있는 반면 소시지는 제한 요원이며 만들 수있는 핫도그의 수를 제어합니다.
그러나 우리는 반응에 사용할 수있는 3.125 몰의 산소를 가지고 있으므로 암모니아 전에 산소가 떨어질 것입니다. 따라서 산소는 제한 반응물이며 암모니아는 초과 할 수 있습니다.
방법 2 :각 반응물에 의해 생성 된 생성물의 양을 비교함으로써
이전 방법에서와 마찬가지로, 우리는 균형 잡힌 화학 방정식으로 시작하여 각 반응물의 두더지 수를 결정하여 계속합니다. 우리는 이전 방법에서 발견 된 것과 동일한 값을 사용할 것입니다.
암모니아의 두더지의 수 =5.86 mol 및 산소의 두더지 수 =3.125 mol.
이제 우리는 각 반응물이 생산할 최종 제품의 양을 발견합니다.
암모니아의 경우, 산화 질소의 몰 (NO) =NH3의 몰이 NH3 =5.86 × 4/4 =5.86 Mol의 NO/화학량 계수 계수의 × 화학량 계수 x.
산소의 경우, 산화 질소의 몰 (NO) =O2의 MOL O2의 O2 =3.125 × 4/5 =2.5 MOL의 NO/화학량 계수 계수의 O2의 O2 몰수 계수
산소에 의해 생성 된 생성물의 양은 암모니아에 의해 생성 된 제품보다 적기 때문에 산소는 제한 반응물이고 암모니아는 과도합니다.
최종 단어
우리가 볼 수 있듯이, 반응에서 제한 시약 또는 제한 반응물은 완전히 소진되어 반응이 계속 진행되는 것을 방지하는 반응물이다. 또한 생산 될 최종 제품의 양을 결정합니다.
제한 반응물을 찾는 것은 반응의 수율을 찾는 데 중요한 단계입니다. 반응의 수율 백분율은 이론적 수율 시간에 대한 실제 수율의 비율입니다. 이론적 수율은 제한 반응물이 완전히 반응한다고 가정 할 때 화학량 론적 계산에 의해 예측 된 수율입니다.
.간단한 단어로, 그것은 제한 반응물에서 생성 된 제품의 양입니다. 우리의 경우, 제한 반응물은 산소이며, 그로부터 생성 된 생성물 (NO)의 양은 2.5 몰이다. 따라서 반응의 이론적 수율은 2.5 몰입니다.
실제 수율은 실험시 얻은 최종 제품의 양입니다. 실험에서 얻은 실제 수율을 2 몰로 가정 해 봅시다. 그 후 수율은 다음과 같습니다.
백분율 수율 =(실제 수율/이론적 수율) × 100 =(2/2.5) × 100 =80%
계산 된 이론적 수율은 일반적으로 생산되는 실제 수율보다 높습니다. 이것은 반응의 가역적 특성, 바람직하지 않은 부산물 생성, 정제 과정의 오류 등을 포함하여 다양한 이유로 인해 발생합니다.