옥트 규칙은 원자가 가장 가까운 고귀한 가스와 유사한 전자 구성을 갖기 위해 원자가 쉘에 8 개의 전자를 갖는 것을 선호한다고 명시하고 있습니다.
옥트 규칙은 원자가 각 원자가 원자가 껍질에 8 개의 전자를 갖도록 결합하는 것을 선호한다고 진술하는 화학 물질“경험 규칙”중 하나입니다. 원자가 쉘은 원자의 외부 쉘입니다. 외부 쉘의 8 개의 전자는 원자가 가장 가까운 고귀한 가스와 유사한 구성을 가질 수있게한다. 이것은 차례로 더 안정적으로 만듭니다.
원자가 껍질에 8 개의 전자를 갖기 위해, 원자는 공유 또는 이온 결합을 형성하는 경향이있다. 이온 결합은 염화나트륨 또는 염에서 관찰되는 반면, 공유 결합은 이산화탄소 또는 CO2에서 볼 수 있습니다. 결합은 반응성이 떨어지고 더 많은 안정성을 누리기 위해 원자에 의해 형성됩니다.
원자가 원자가에 8 개의 전자가 안정적인 상태가되기 위해 어떻게 및 이유를 이해하려면, 전자가 원자에 분포되는 방식을 이해하는 것으로 시작합시다.
.
How are electrons distributed in an atom?
원자는 요소의 가장 작은 입자이지만 그 안에는 그 자체의 우주가 있습니다. 이 작은 우주의 일부를 형성하는 3 개의 아 원자 입자는 중성자, 양성자 및 전자입니다. 중성자는 순 전하가 없으며 긍정적으로 하전 된 양성자와 함께 원자의 중심에 있습니다. 중성자와 양성자는 함께 원자의 핵을 형성합니다. 전자는 태양 주위의 행성처럼 핵을 돌리는 음으로 하전 된 입자입니다.
전자와 양성자는 전기 전하 입자 사이의 물리적 상호 작용 인 전자기 힘에 의해 서로 끌어 당깁니다. 따라서, 핵에서 전자를 분리하려면 많은 에너지가 필요합니다. 전자가 핵에 가까울수록 분리하는 데 필요한 에너지가 높아집니다.
전자는 핵에서 시작하여 바깥쪽으로 팽창하여 K, L, M 및 N이라는 다른 껍질에서 회전합니다. 각 프로그레시브 쉘은 1, 2, 3 또는 4에 해당하는 다른 에너지 수준을 갖습니다. 각 쉘이 포함 할 수있는 최대 전자 수는 2 (n2)로 주어집니다. 여기서 n은 에너지 수준에 해당합니다. 따라서 K에는 2 개의 전자 [2 (1) 2 =2], L에는 8 개의 전자가 있고, M에는 18 개의 전자가 있고 N에는 32 개의 전자가 있습니다.
에는 3 개의 전자가 있습니다.
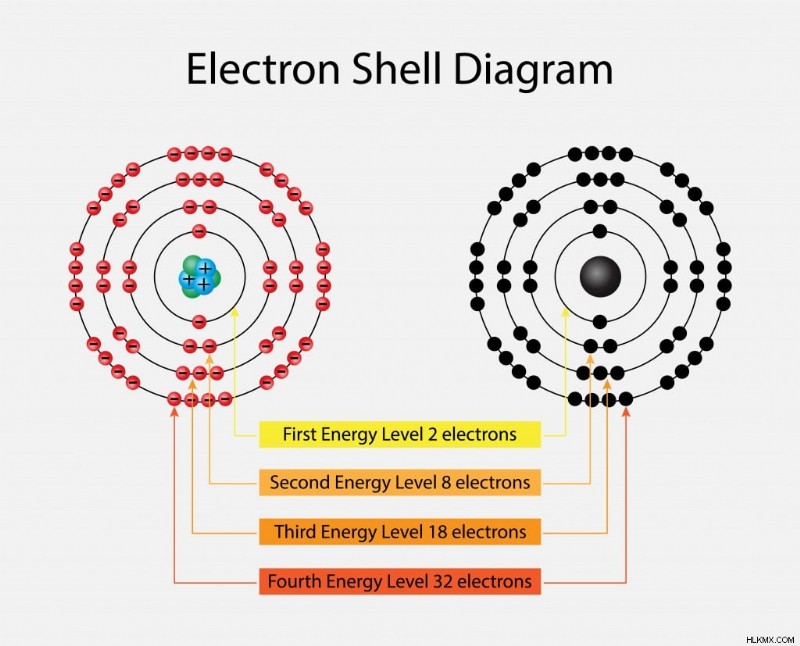
전자 쉘. (사진 크레디트 :nasky/ shutterstock)
또한,이 쉘은 원자 궤도를 함유하는 서브 쉘로 나뉩니다. 쉘에는 s, p, d, 라는 궤도가 포함되어 있습니다 및 f, 핵에서 시작합니다. 껍질과 서브 쉘에 전자의 배열을 원자의 전자 구성이라고합니다.
쉘의 수는 원자에 존재하는 전자의 수에 따라 증가합니다. 요소의 가장 바깥 쪽 쉘은 원자가 쉘이라고하며 전자는 원자가 전자라고 불리는 전자입니다.
원자가 껍질은 무엇입니까?
원자가 전자는 화학 반응에 참여하는 원자의 경향에 기여합니다. 원자가 쉘에 8 개의 전자를 함유하는 폐쇄 쉘이있는 원자는 화학 반응에 거의 참여하지 않기 때문에 화학적으로 불활성으로 간주됩니다. 그러한 원소의 원자는 고귀한 가스와 유사한 전자 구성을 갖습니다.
주기율표는 전자 구성, 특성 및 원자 번호로 배열 된 모든 알려진 요소를 포함하는 표 배열입니다. 테이블의 오른쪽 끝에는 고귀한 가스라는 요소 그룹이 있습니다. 그들은 완전히 채워진 원자가 껍질을 가지고 있기 때문에 안정된 것으로 간주됩니다. 8 개의 고귀한 가스는 헬륨 (2), 네온 (10), 아르곤 (18), 크립톤 (36), Xenon (54) 및 방사성 요소 라돈 (86)입니다. 각 브래킷에는 원자의 원자 수가 포함되어 있습니다.
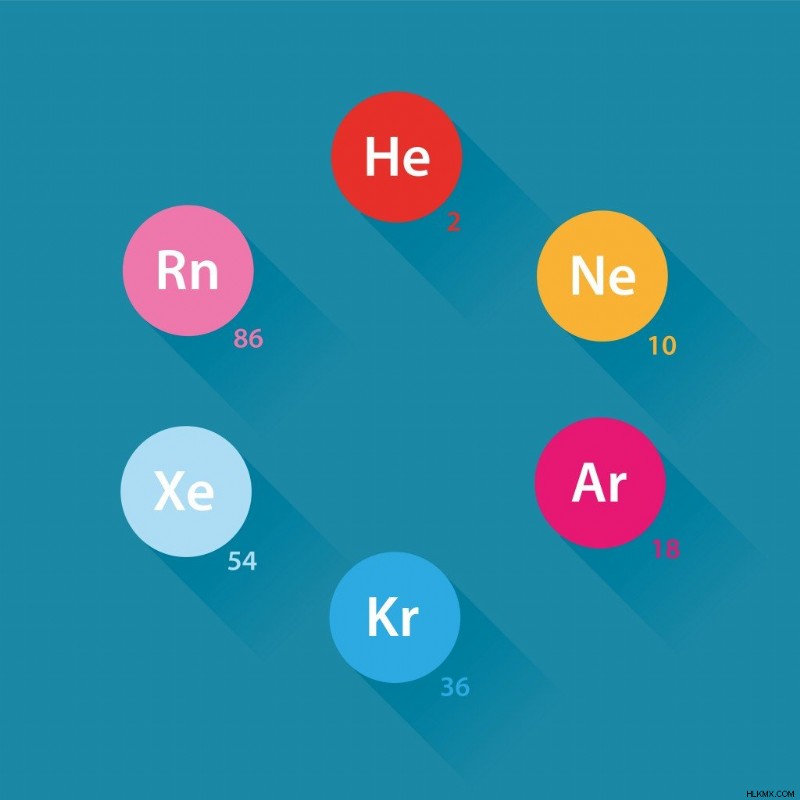
고귀한 가스. (사진 크레딧 :Daumier/Shutterstock)
고귀한 가스는 외부 에너지 수준이 이미 가득 차기 때문에 반응이 가장 적습니다. 외부 껍질에 8 개의 전자가 존재하면 고귀한 가스의 원자가 0이됩니다. 다른 반응성 원자는 고귀한 가스의 안정성에 접근하기 위해 옥트 규칙을 따름 8 개의 전자로 외부 쉘을 채우는 경향이 있습니다.
옥트 규칙은 s 에 존재하는 전자 만 고려합니다. 및 p 하위 쉘. 이 서브 쉘은 최대 8 개의 전자를 가장 바깥 쪽 쉘에 담을 수 있습니다.
원자가 전자는 최고의 에너지 수준에 위치한 전자이기 때문에 원자가가 보유하는 가장 중요한 전자 중 일부라고 생각할 수 있습니다. 이들은 화학 반응에 가장 일반적으로 관여하는 전자입니다. 원자가 전자는 Lewis Electron Dot 구조를 사용하여 계산할 수 있습니다.
Lewis Electron Dot 구조 (LED)는 무엇입니까?
루이스 구조는 1916 년 그의 기사“원자와 분자”라는 기사에서 개념을 처음 소개 한 길버트 N. 루이스의 이름을 따서 명명되었습니다. 루이스 구조는 원자가 전자를 나타내며, 이는 원자가 주위의 점으로 식별되는 원자가 전자를 나타내는 각 점. 대부분의 경우, 원자가 쉘에 8 미만의 전자가있는 원자는 공유 결합 또는 이온 결합에 의해 화합물을 형성하는 것을 선호합니다.
.그러한 결합의 형성은 옥셋 규칙을 충족시킬 수있다. 주기율표의 두 번째 그룹의 요소는 원자들 사이에 전자를 잃거나, 얻거나 공유함으로써 8 개의 전자의 기준을 충족시킵니다.
형성된 결합의 유형은 원자가 쉘의 전자 수와 결합을 형성하는 데 필요한 총 에너지에 따라 다릅니다. LED는 화학 반응을 위해 얼마나 많은 자유 전자를 사용할 수 있는지 식별하는 데 도움이됩니다.
공유 결합은 무엇입니까?
공유 결합은 각 원자가 가장 가까운 고귀한 가스와 유사한 전자 구조를 갖도록 전자를 공유 할 수있는 2 개의 원자 사이의 연결입니다.
예를 들어 이산화탄소를 섭취하십시오. 탄소와 산소는 각각 6과 8의 원자 수를 갖습니다. 탄소에는 K 쉘에 2 개의 전자가있는 2 개의 쉘 K 및 L이 있으며 L 쉘에 4 개의 전자가 남습니다. 안정성을 달성하기 위해 탄소는 4 개의 전자를 모두 잃고 헬륨에 가장 가까이 있거나 4 개의 전자를 얻고 네온에 가장 가깝습니다. 4 개의 전자를 얻거나 잃는 데 필요한 에너지는 핵의 양성자와 전자 사이의 매력적인 힘으로 인해 엄청납니다. 그러나 중간지면 옵션은 전자를 공유하는 것입니다.
유사하게, 산소는 K 쉘에 2 개의 전자와 L 쉘에 6 개의 전자를 갖는다. 안정된 2 개의 전자 만 필요하며 Neon과 유사한 전자 구성을 얻습니다. 4 개의 전자를 잃는 것보다 2 개의 전자를 얻는 것이 더 쉽습니다 (헬륨과 유사하게 만들 수 있음). 조정으로, 2 개의 산소 원자는 전자를 단일 탄소 원자와 공유하여 3 개의 모두가 원자가 껍질에 8 개의 전자를 갖고 각각 개별적으로 안정적입니다.
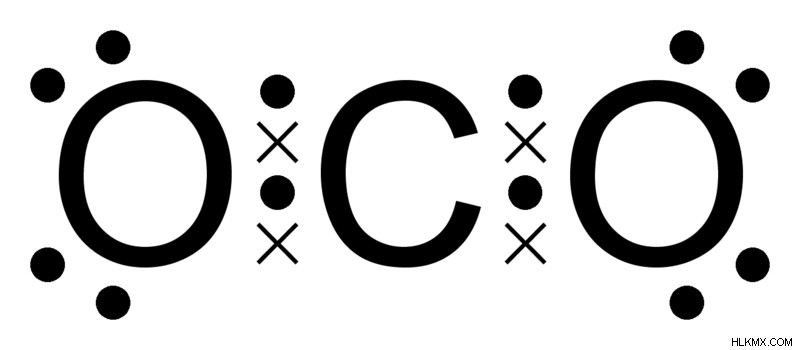
CO2를 보여주는 루이스 도트 구조. X는 탄소의 전자를 나타내고 점은 산소의 전자를 나타냅니다. (사진 크레딧 :Ben Mills /Wikimedia Commons)
결과는 하나의 탄소 원자와 2 개의 산소 원자를 갖는 이산화탄소 분자이며, 각각은 원자가 쉘에 개별적으로 8 개의 전자를 갖는다.
.이온 결합은 무엇입니까?
이온 결합은 반대로 하전 된 이온 사이에서 발생하는 화학적 결합의 한 유형입니다. 원자는 원자가 초과하는 양성자 또는 전자의 수에 따라 양성 또는 음으로 하전 될 수있다. 이온은 전자의 게인 또는 손실로 인한 순 전하의 원자입니다. 전자가 음으로 하전되며, 원자가 전자를 얻는 경우 음전하가 발생하지만 전자를 잃으면 양전하가됩니다. 요컨대, 이온은 특정 전하를 포함하는 원자입니다.
이온 결합은 금속과 비금속 사이에 발생하며, 하나는 전기 양성이고 다른 하나는 전기 음성입니다. 전기 양성 금속은 전자가 양이온이라고하는 양의 이온이되기 위해 전자를 잃는 반면, 전기 음성 비금속은 전자를 받아들이고 음이온이라고하는 음으로 하전 된 이온이됩니다. 전자의 손실과 수용은 이온 결합을 형성하기 위해 동일하며, 동시에 각 원자는 옥트 규칙을 만족시킵니다!
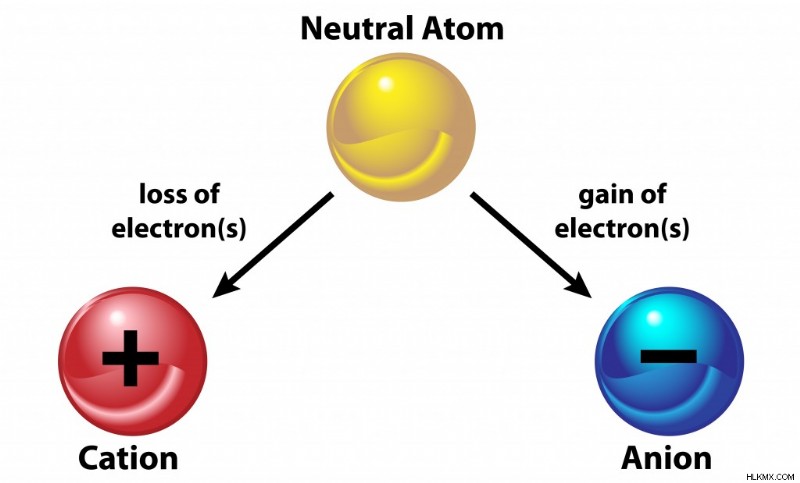
양이온과 음이온. (사진 크레딧 :Osweetnature/Shutterstock)
따라서 원자에 전자와 양성자가 불평등 한 경우 이온이라고합니다. 결과적으로, 전자를 잃거나 얻는 데 불평등 한 2 개의 원자가 모여 이온 결합을 통해 중립 전하를 얻습니다. 그들은 그들 사이의 매력적인 힘의 도움으로 여전히 유대감을 유지합니다. 순 결과는 8 개의 전자가있는 완전히 채워진 원자가 쉘을 갖기 때문에 각 원자는 안정적입니다.
염 또는 염화나트륨은 이온 결합의 훌륭한 예입니다. 나트륨은 각각 k, l 및 m 쉘에서 2, 8 및 1 개의 전자를 갖는 원자 수가 11입니다. 이것은 원자가 껍질에 1 개의 전자를 남기고, 반응 중에 나트륨 원자가 쉽게 잃어 버립니다. 염소는 K, L 및 M 쉘에 2, 8 및 7 개의 전자가있는 원자 수가 17입니다. 염소는 원자가 껍질에 7 개의 전자를 가지고있어 전기 음성이 매우 높습니다. 각 원자는 완전히 채워진 원자가 쉘을 갖도록 1 전자를 조정하고 가장 가까운 고귀한 가스와 비슷한 구성을 얻는 것만으로도.
.
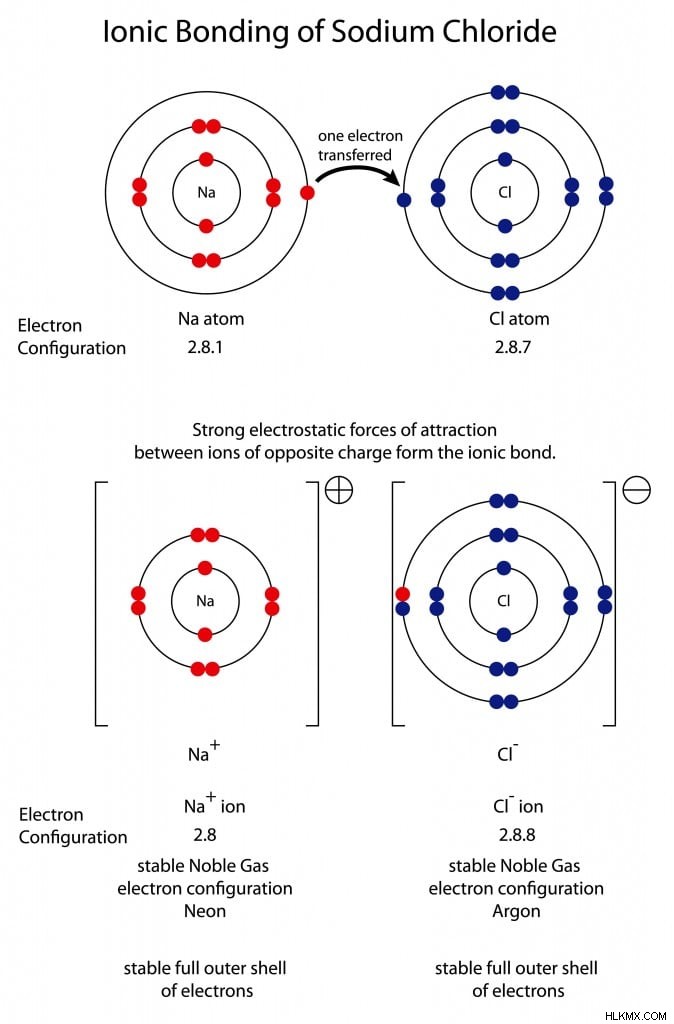
염화나트륨에서의 이온 결합 (염). (사진 크레딧 :Steve Cymro/Shutterstock)
나트륨 또는 염소의 경우 7 개의 전자를 얻거나 잃는 데 필요한 에너지는 엄청납니다. 공정을보다 쉽게하기 위해 나트륨은 고독한 전자를 잃고 네온과 유사한 전자 구성을 획득합니다 (10). 염소는 나트륨에 의해 손실 된 전자를 받아들이고 아르곤과 유사한 전자 구성을 달성합니다 (18). 최종 결과는 나트륨과 염소 사이의 이온 결합으로 소금을줍니다.
기본 테이블 소금이 복잡한 화학 이력을 가질 수 있다고 생각하지 않았습니다!
옥트 규칙에 대한 예외는 무엇입니까?
수업 시간에 규칙을 어기는 것을 좋아하는 한 아이는 항상 화학에서도 마찬가지입니다. 옥트 규칙을 따르지 않는 요소의 예가 있습니다. 간단히 살펴 보겠습니다.
홀수의 전자가있는 분자는 일반적으로 옥트 규칙을 따르지 않습니다. 또한 전자가 2 개 (총) 만있는 원자가이 범주에 속합니다.
원자 수가 1 인 수소 원자는 최대 2 개의 전자를 유지할 수 있지만,이 원자는 s 을 갖는 하나의 전자 쉘만 있습니다. 궤도 함수. 옥트 규칙이 s and p 에 적용됨에 따라 궤도 만, 2 개의 전자가있는 원자는 규칙에 대한 예외입니다.
마지막으로, 하나 이상의 원자가 8 개 미만의 전자를 갖는 분자도 예외입니다.
옥트 규칙은 화학에서 가장 중요한 규칙 중 하나이며 원자가 8 개의 전자를 원자가 껍질에 고정하기 위해 원자가 서로 반응하는 방법을 지배합니다. 공유 또는 이온 결합을 형성하는 것은 원자가 옥틴 규칙을 만족시키는 가장 편리한 방법입니다. 결국, 원자는 아마도 항상 반응성에 지치고 아마도 평화와 안정성을 갖기 위해 옥트 규칙을 따르십시오!







