녹은 전기 도체가 열악한 전기 전기입니다. 이온이 자유롭게 움직일 수없는 이온 성 화합물이기 때문입니다.
오래된 배터리를 사용하여 장치에 전원을 공급 한 적이 있다면 항상 품목에 충분히 전원을 공급하는 것은 아닙니다. 면밀히 검사하면 터미널을 덮는 주황색 빨강 조각을 찾을 수도 있습니다. 이 플레이크를 제거한 후 장치는 잘 작동합니다.
그러나 왜이 플레이크가 셀에서 발달했으며 플레이크를 제거하기 전에 배터리가 충분한 전력을 공급하지 않았습니까?

녹슬었던 터미널은 개방 회로로 이어질 수 있습니다. (사진 크레디트 :Twenty20)
이러한 질문에 답하는 과학 분야는 e lectrochemistry 입니다. .
전도에 관한 단어
전위차의 적용으로 인한 전하 운반체의 방향 흐름을 허용하는 물질의 특성을 전기 전도 이라고합니다. . 시간이 지남 한이 전하 운반체 의이 방향 흐름은 전류 이라고합니다. . 전도도는 (내부 구조에만 따라) 내재 된 속성이며 다음과 같이 정량화됩니다.
재료의 전도도,  는 1 을 통해 흐르는 전류입니다. m 1 인 긴 샘플 m2 단위 전압 (1 볼트)이 적용될 때 단면에 의해. 수학적으로, 관계는 다음과 같이 표현된다 :
는 1 을 통해 흐르는 전류입니다. m 1 인 긴 샘플 m2 단위 전압 (1 볼트)이 적용될 때 단면에 의해. 수학적으로, 관계는 다음과 같이 표현된다 :
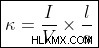 where,
where,
i =전류 (출력으로 측정)
v =응용 전압 (입력)
l =샘플 길이
a =단면의 면적
전도는 전하 흐름의 척도이기 때문에, 자유 전하 운반체 (이온, 전자, 양성자)를 포함하는 재료 만 전기를 전도 할 수 있습니다.
Rust의 화학
녹은 물이 존재할 때 금속 철과 산소 사이의 산화 환원 반응의 화학 생성물이며, 이는 촉매로서 작용한다 (반응 속도 속도를 높임). 철은 주황색 갈색에서 빨간색까지 다양한 산화철로 산화됩니다. Rust는 이러한 모든 철 산화물 및 철 하이드 록 사이드를 언급하는 일반적인 이름 입니다. .
녹 화학 반응
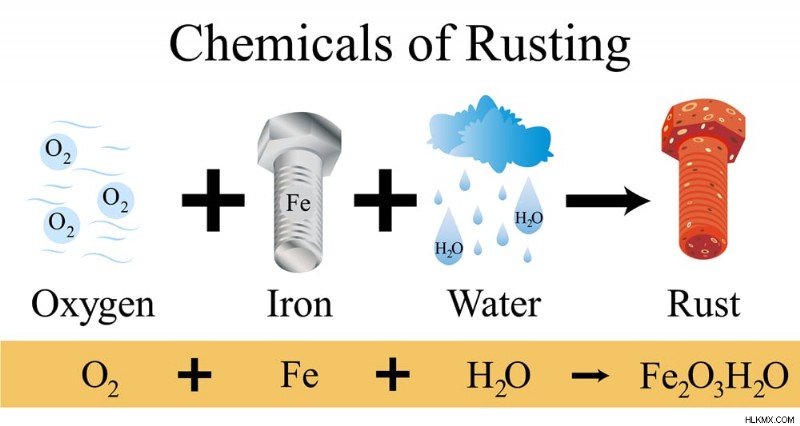
녹의 화학 반응. (사진 크레딧 :Sansanorth/Shutterstock)
녹 형성에 대한 반응은 반응의 속도와 녹 형성을 지시하는 다양한 하위 반응으로 구성됩니다. 이것은 철이 산화되고 산소가 감소하는 산화 환원 반응입니다. 관련된 반응물은 금속 철이다 ( fe ), 대기로부터의 산소 가스 ( O2 ) 및 수증기/수분 ( H2O ).
- fe ( s ) ——> fe2+ ( aq ) + 2e– :이 단계에서 고체 철은 수분이있을 때 두 개의 전자 (산화)를 잃습니다
- 4fe2+ ( aq ) + o 2 ——> 4 fe3+ + 2 o2- : Fe2+ 의 추가 산화 대기 산소의 존재로 인해 발생합니다
- O2 + 4 E- + 2H2O ——> 4 OH- : Fe 의 산화로부터 방출 된 전자 산소를 OH - 으로 줄입니다
- Fe2 + + 2H2O ⇌ Fe (OH) 2 + 2H + : fe2+ 물의 이온은 fe (OH) 2 로 수화됩니다
- Fe3 + + 3H2O ⇌ Fe (OH) 3 + 3 H + : fe3+ 물의 이온은 fe (OH) 3 로 수화됩니다
- fe (OH) 2 ——> feo + h2o :물이 제거되면 (탈수) Feo 및 Fe2O3가 형성됩니다
- 2feo ——> Fe2O3 + H2O
녹은 fe (OH) 2 의 일반적인 용어입니다 , fe (OH) 3 , Feo, Fe2O3 및 고도로 산화물 및 수산화 철의
화학 결합의 특성
전도도는 전압으로 인한 전하 운송 업체의 순서 이동에서 발생하는 특성임을 상기하십시오. 전하 캐리어는 이온, 전자 또는 양성자 일 수 있습니다. 무료 충전 운송 업체가 존재하지 않으면 전압을 적용 할 때 전류가 흐르지 않습니다.
이온 결합에 대한
fe (OH) 2 , fe (OH) 3 , feo 및 fe2o 3 모든 이온 성 화합물입니다. 이온 성 화합물은 금속 원자 (Fe)가 전자를 비금속 원자에 기증 할 때 형성된다. 금속 원자는 양전하를 얻고 비금속 원자는 음전하를 얻어 이온의 형성을 초래한다. 이것은 반대로 하전 된 두 이온 사이의 정전기 인력을 유발합니다. 이 매력은 이온을 가까이 유지 하며이 결합을 이온 결합이라고합니다. 금속에서 비 금속으로 전자의 전달로 인해 형성된 화합물을 이온 성 화합물이라고합니다.
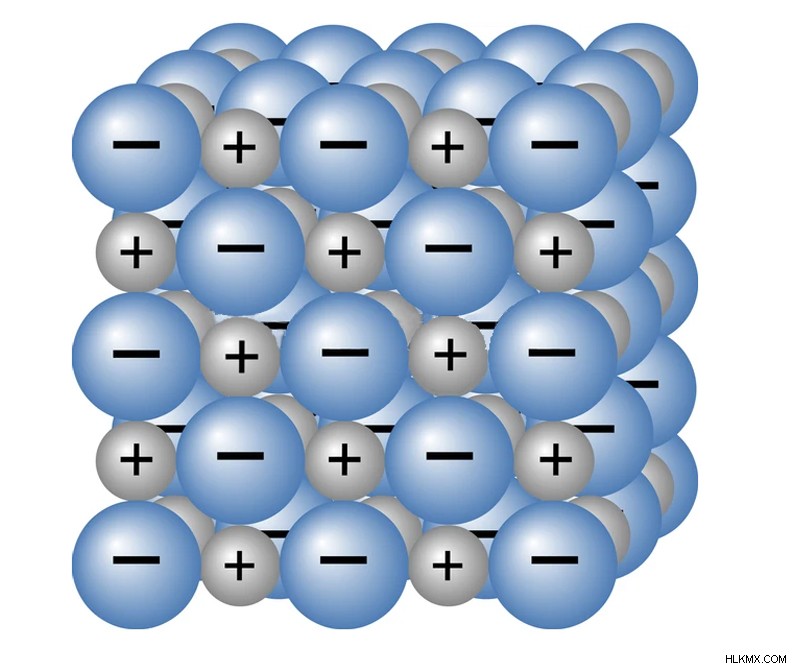
이온들 사이의 매력의 정전기력은 실내 온도에서 견고하게 유지할 수있을 정도로 강하다. (사진 크레딧 :Osweetnature/Shutterstock)
녹이 절연체 인 이유는 무엇입니까?
수용액에서, 용융 또는 기체 형태로, 이온은 자유롭게 움직여서 전기를 수행한다. 그러나, 고체에서, 이온은 자유롭게 움직일 수 없으며, 대신 결정을 형성하기 위해 강하게 결합된다. 이온/전하 운반체가 전압의 존재하에 이동하는 경향을 이동성이라고합니다.
전하 운반체의 움직임으로 인해 전도도가 발생하기 때문에 드리프트 속도라고 불리는 특징적인 속도가 있습니다. vd , 어떤 충전 운송 업체가 이동하는지. 드리프트 속도가 클수록 전류가 커집니다. 또한 전압은 전기장 인 e 을 생성합니다 . 이동성은 vd 의 관점에서 정의됩니다 및 e AS :
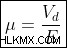
이온은 고체 결정으로 자유롭게 움직일 수 없기 때문에 녹슬 으면 전기를 전도 할 수 없습니다!