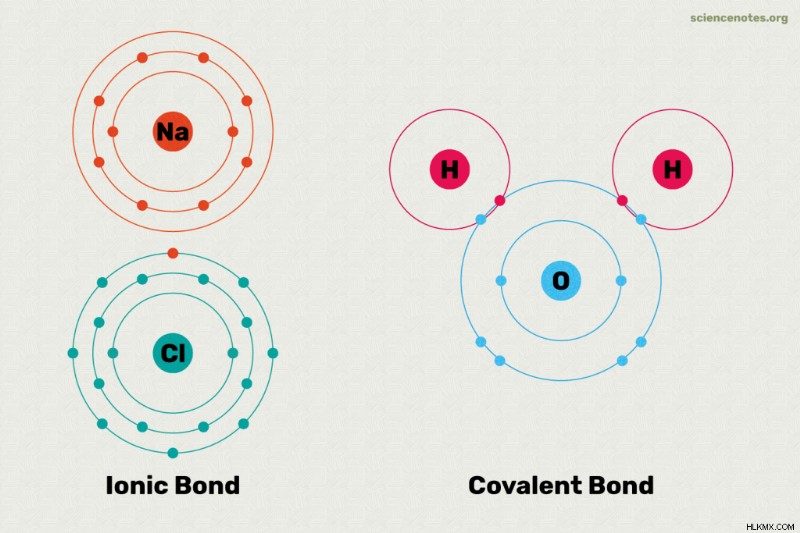
이온 성 및 공유 결합은 화학적 결합의 두 가지 주요 유형입니다. 화학적 결합은 둘 이상의 원자 또는 이온 사이에 형성된 링크입니다. 이온 성과 공유 결합의 주요 차이점은 전자가 결합에서 원자들 사이에서 얼마나 똑같이 공유되는지입니다. 다음은 이온 성과 공유 결합의 차이, 각 결합 유형의 예, 어떤 유형의 결합이 형성 될지 알리는 방법을 살펴 보는 것입니다.
키 포인트
- 두 가지 주요 유형의 화학적 결합은 이온 성 및 공유 결합입니다. 금속 결합이라는 세 번째 유형의 화학 결합을 통한 금속 결합.
- 이온 성과 공유 결합의 주요 차이점은 하나의 원자는 본질적으로 이온 결합에서 다른 원자에 전자를 기증하는 반면 전자는 공유 결합에서 원자 사이에 공유된다는 것입니다. .
- 이온 결합은 금속과 비금속 사이에 형성됩니다. 공유 결합은 두 비금속 사이에 형성됩니다. 금속 결합은 두 금속 사이에 형성됩니다.
- 공유 결합은 순수 또는 진정한 공유 결합 및 극성 공유 결합으로 분류됩니다. 전자는 순수한 공유 결합에서 원자 사이에 동일하게 공유되는 반면, 극성 공유 결합에서 불평등하게 공유됩니다 (다른 원자보다 한 원자와 더 많은 시간을 보내십시오). .
이온 결합
이온 성 결합에서, 하나의 원자는 전자를 다른 원자에 기부한다. 이것은 두 원자를 안정화시킵니다. 한 원자는 본질적으로 전자를 얻고 다른 원자는 그것을 잃어 버리기 때문에, 이온 결합은 극성입니다. 다시 말해서, 결합의 한 원자는 양전하가 있고 다른 하나는 음전하를 갖는다. 종종,이 원자는 물에서 이온에 분리됩니다. 이온 결합에 참여하는 원자는 서로 다른 전기 음성 값을 갖는다. 전기 음성 값의 표를 보면 금속과 비금속 사이에서 이온 결합이 발생합니다. 이온 결합을 갖는 화합물의 예는 테이블 소금 (NaCl)과 같은 소금을 포함한다. 소금에서 나트륨 원자는 전자를 기증하므로 NA 이온을 물에 생성하는 반면 염소 원자는 전자를 얻고 물의 Cl 이온이됩니다.
.
공유 결합
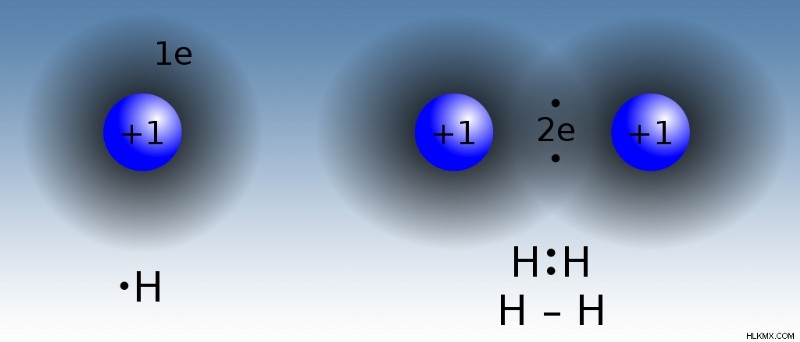
원자는 공유 결합에서 공유 전자에 의해 결합된다. 진정한 공유 결합에서, 원자는 서로 동일한 전기 음성 값을 갖는다. 이 유형의 공유 결합은 수소와 같은 동일한 원자 (H 2 사이의 공유 결합 형태입니다. ) 및 오존 (O 3 ). 진정한 공유 결합에서, 전하는 원자 사이에 고르게 분포되므로 결합이 비극성이됩니다. 약간 다른 전기 음성 값을 갖는 원자들 사이의 공유 결합은 극성 공유 결합을 초래한다. 그러나, 극성 공유 결합에서의 극성은 이온 결합보다 작다. 극성 공유 결합에서, 결합 전자는 다른 원자보다 하나의 원자에 더 끌린다. 물의 수소와 산소 원자 사이의 결합 (H 2 o)는 극성 공유 결합의 좋은 예입니다. 공유 결합은 비금속 사이에 형성됩니다. 공유 화합물은 물에 용해 될 수 있지만 이온에 분리되지는 않습니다. 예를 들어, 설탕을 물에 녹인 경우 여전히 설탕입니다.
이온 성 대 공유 결합 요약
다음은 이온 성과 공유 결합의 차이점, 특성 및이를 인식하는 방법에 대한 빠른 요약입니다.
| 이온 결합 | 공유 결합 | |
| 설명 | 금속과 비금속 사이의 결합. 비금속은 전자를 끌어 들이기 때문에 금속이 전자를 기증하는 것과 같습니다. | .유사한 전기성이있는 두 비금속 사이의 결합. 원자는 외부 궤도에서 전자를 공유합니다. |
| 전기 음성 | 참가자 간의 큰 전기 음성 차이 | 참가자 간의 제로 또는 작은 전기 음성 차이 |
| 극성 | 높음 | 낮음 |
| 모양 | 명확한 모양 없음 | 명확한 모양 |
| 용융점 | 높음 | 낮음 |
| 끓는점 | 높음 | 낮음 |
| 실온에서 상태 | 솔리드 | 액체 또는 가스 |
| 예 | 염화나트륨 (NaCl), 황산 (H 2 그래서 | 메탄 (ch 4 ), 염산 (HCl) |
| 화학 종 | 금속과 nometal (수소는 어느 쪽이든 작용할 수 있음) | 두 비금속 |