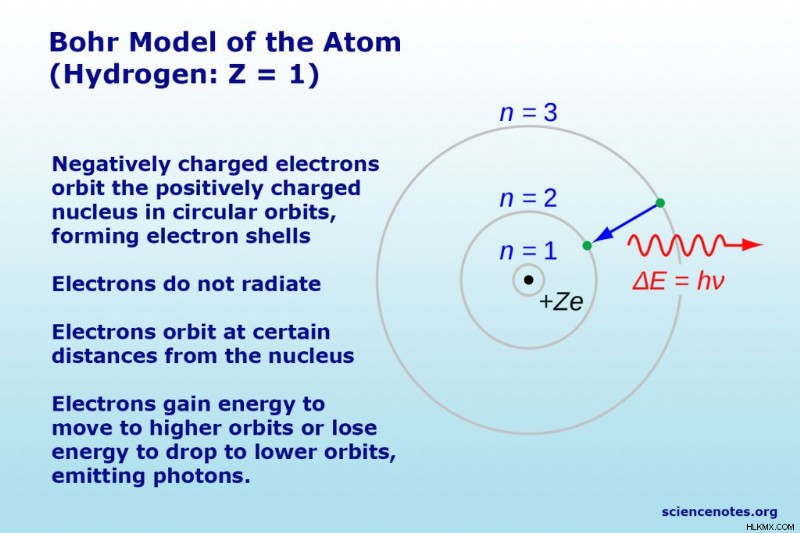
원자의 Bohr 모델 또는 Rutherford-Bohr 모델은 주로 양자 이론 측면에서 원자의 구조를 설명하는 케이크 또는 행성 모델입니다. 전자가 행성과 같은 원자 핵을 태양을 공전하는 반면, 원형 전자 궤도는 케이크 층처럼 껍질을 형성하기 때문에 행성 또는 케이크 모델이라고합니다. 덴마크 물리학 자 닐스 보어 (Niels Bohr)는 1913 년 에이 모델을 제안했다.
BOHR 모델은 일부 양자 역학을 통합 한 최초의 원자 모델이었습니다. 초기 모델은 입방 모델 (1902), Plum-Pudding Model (1904), Saturnian Model (1904) 및 Rutherford Model (1911)이었습니다. 궁극적으로 양자 역학을 기반으로 한 모델은 BOHR 모델을 대체했습니다. 그러나 이것은 전자의 양자 거동을 간단한 용어로 설명하고 수소의 스펙트럼 방출 라인에 대한 Rydberg 공식을 설명하기 때문에 중요한 모델입니다.
BOHR 모델의 주요 점
- 원자 핵은 양성자와 중성자로 구성되며 순 양적 전하가 있습니다.
- 전자는 음전하를 가지며 핵을 궤도로 궤도에 넣습니다.
- 전자 궤도는 원형이지만 동일한 평면 (별 주위의 행성과 같은)에서 모든 전자 궤도가 아니기 때문에 전자가 발견 될 수있는 구체 나 껍질이 생깁니다. 중력은 별 주위의 행성의 궤도를 결정하는 반면, 정전기력 (쿨롱 힘)은 전자가 핵을 공전하게합니다.
- 전자 (가장 안정적인 상태)의 가장 낮은 에너지는 핵에 가장 가까운 가장 작은 궤도에 있습니다.
- 전자가 한 궤도에서 다른 궤도로 이동하면 에너지가 흡수되거나 (하위에서 고도로 궤도로 이동) 방출 (더 높은 궤도로 이동)
수소의 BOHR 모델
BOHR 모델의 가장 간단한 예는 수소 원자 (Z =1) 또는 수소 유사 이온 (Z> 1)에 대한 것입니다. 이 모델에 따르면, 전자는 특정 궤도 만 차지합니다. 가능한 궤도의 반경은 n의 함수로서 증가하며, 여기서 n은 원리 양자 수이다. 전자가 한 궤도에서 다른 궤도로 이동하면 에너지가 흡수되거나 방출됩니다. 3 → 2 전환은 Balmer 시리즈의 첫 번째 줄을 생성합니다. 수소 (Z =1)의 경우,이 라인은 파장이 656 nm (빨간색) 인 광자로 구성됩니다.
무거운 원자에 대한BOHR 모델
수소 원자는 하나의 양성자 만 포함하는 반면, 무거운 원자는 더 많은 양성자를 함유한다. 원자는 다수의 양성자의 양전하를 취소하기 위해 추가 전자가 필요하다. Bohr 모델에 따르면, 각 궤도에는 특정 수의 전자 만 보유합니다. 레벨이 채워지면 추가 전자가 다음 높이를 차지합니다. 따라서 더 무거운 전자의 Bohr 모델은 전자 쉘을 도입합니다. 이것은 더 많은 양성자와 전자를 함유하더라도 주기율표의주기 (행)에 걸쳐 원자가 더 작아지는 이유와 같은 무거운 원자의 일부 특성을 설명합니다. 이 모델은 또한 고귀한 가스가 불활성 인 이유,주기 테이블의 왼쪽에있는 원자가 전자를 끌어들이는 이유, 오른쪽의 요소 (고귀한 가스 제외)가 전자를 잃는 이유를 설명합니다.
BOHR 모델을 무거운 원자에 적용하는 한 가지 문제는 모델이 전자 쉘이 상호 작용하지 않는다고 가정한다는 것입니다. 따라서이 모델은 전자가 정기적으로 쌓이지 않는 이유를 설명하지 않습니다.
BOHR 모델의 문제
BOHR 모델은 이전 모델을 능가하고 흡수 및 방출 스펙트럼을 설명했지만 몇 가지 문제가있었습니다.
- 모델은 큰 원자의 스펙트럼을 예측할 수 없었습니다.
- Zeeman 효과를 설명하지 않습니다.
- 스펙트럼 라인의 상대 강도를 예측하지 않습니다.
- 이 모델은 전자의 반경과 궤도를 모두 정의하기 때문에 Heisenberg 불확실성 원리를 위반합니다.
- 지상 상태 각 운동량을 잘못 계산합니다. Bohr 모델에 따르면, 지상 상태 각도 운동량은 l 입니다. = . 실험 데이터는 l =0을 보여줍니다.
- Bohr 모델은 스펙트럼 라인의 미세하고 과도한 구조를 설명하지 않습니다.
BOHR 모델 개선
Sommerfeld 또는 Bohr-Sommerfeld 모델은 원형 궤도가 아닌 타원형 전자 궤도를 설명함으로써 원래 BOHR 모델에서 크게 개선되었습니다. 이를 통해 Sommerfeld 모델은 스펙트럼 라인 분할의 뚜렷한 효과와 같은 원자 효과를 설명 할 수있었습니다. 그러나 Sommerfeld 모델은 자기 양자 수를 수용 할 수 없었습니다.
1925 년 Wolfgang의 Pauli의 원자 모델은 Bohr 모델과이를 기반으로 한 모델을 대체했습니다. Pauli의 모델은 순전히 양자 역학을 기반으로 했으므로 BOHR 모델보다 더 많은 현상을 설명했습니다. 1926 년에 Erwin Schrodinger의 방정식은 파도 역학을 도입하여 오늘날 사용되는 Pauli의 모델을 수정했습니다.
참조
- Bohr, Niels (1913). “원자와 분자의 구성에서, 1 부. 철학 잡지 . 26 (151) :1–24. doi :10.1080/1478641308634955
- Bohr, Niels (1914). “헬륨과 수소의 스펙트럼”. 자연 . 92 (2295) :231–232. doi :10.1038/092231d0
- Lakhtakia, Akhlesh; Salpeter, Edwin E. (1996). "수소의 모델과 모델러". American Journal of Physics . 65 (9) :933. Bibcode :1997amjph..65..933L. doi :10.1119/1.18691
- Pauling, Linus (1970). “5-1 장”. 일반 화학 (제 3 판). 샌프란시스코 :W.H. Freeman &Co. ISBN 0-486-65622-5.