무수물은 산에서 물 분자를 제거하여 형성된 하나의 화학 생성물입니다. 이제 무수물은 무엇입니까? 산소 원자는 기능 그룹을 정의하는 두 개의 아실기를 연결합니다. 무수물은“물없이”를 의미합니다. 물이 다른 화학 물질에서 제거 될 때 생성 된 화학 물질로 설명 할 수 있습니다. 무수물 및 물은 결합되어 염기 또는 산을 형성 할 수 있습니다. 혼합 무수물은 2 개의 상이한 카르 복실 산으로부터 생성되며 아래에 도시 된 일반 구조에서 상이한 R기를 갖는 것으로 정의된다. 이제 산 무수물에 대해 배우자.
산 무수물의 정의와 의미
산성 용액을 형성하기 위해 물과 반응하는 비 금속 산화물을 산 무수물이라고합니다. 이것은 물에서 산성 용액을 형성 할 수있는 분자입니다. 산소 원자에 의해 연결된 2 개의 아실 그룹으로 구성된 유기 화학의 기능적 그룹이다. 물과 반응 할 수있는 비금속은 엄격하게 무수물이라고 불리며, 물과 반응 할 수없는 비 메탈은 무수물로 간주되지 않습니다.
유기 화학에 따르면, 유기산 무수물은 기능적 그룹 R (CO) O (CO) r '을 갖는다. 유기산 무수물은 종종 탈수 반응에서 유기산의 2 가지에 상당한 물에서 물을 제거 할 때 종종 형성됩니다.
.일반적인 산 무수물 구조
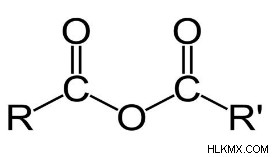
여기 r과 r‘모든 알칸 그룹입니다.
아세트산 무수물 공식
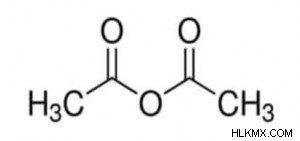
이것은 아세트산 무수물 분자입니다. 메탄 (CH3) 그룹으로 대체 될 때 위의 R과 R '은 우리에게 아세트산 무수물 공식을 제공합니다. 이 분자는 산 무수물의 기본 예 중 하나입니다.
산 무수물 합성
산성 무수물은 동일한 산소 원자에 부착 된 2 개의 아실기 (R-C =O)를 갖는 물질이다. 카르 복실 산이 산 염화물과 결합 될 때,이 반응은 종종 염기의 존재하에 무수물을 초래한다. 2 개의 카르 복실 산은 유기산 무수물을 생성하기 위해 800 ℃ 이상의 고온에서 가열된다. 이 단계에서, 물 분자는 반응에서 제거된다. 카르 복실 산은 p 2 와 반응하고 생성하는 데 사용될 수 있습니다. o 5 .
탈수 방법은 산 무수물 합성의 화학적 반응을 보여줍니다.
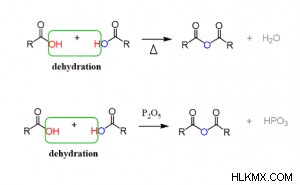
여기 r Alkane 그룹입니다.
산 무수물의 물리적 특성
acetic anhydride를 물리적 특성의 전형적인 예로 생각해 봅시다.
외관 - 아세트산 무수물로도 알려진 아세트산 무수물은 식초 (아세트산)의 특징적인 냄새를 가진 무색 액체입니다. 냄새는 아세트산 무수물이 공기 중의 수증기 및 코의 습기와 결합되어 아세트산을 개혁 할 때 생성됩니다. 물과 의이 반응은 다른 페이지에 자세히 설명되어 있습니다.
수용성 - 아세트산 무수물은 물과 결합하여 아세트산을 형성하므로 물에 용해 될 수는 없습니다. 아세트산 무수물의 수용액은 존재하지 않습니다.
끓는점 - 절대 에탄올은 140 ℃에서 끓는다. 그것들은 다소 다이폴과 반 데르 발스 분산 힘을 가진 다소 큰 극성 분자입니다. 그러나 수소 결합을 형성하지는 않습니다. 이것은 비교적 크기의 카르 복실 산보다 더 낮은 비등점을 나타냅니다. 예를 들어, 펜타 노산은 크기가 가장 가까운 산이며 186 ° C에서 끓습니다.
산 무수물의 반응성
- 산 무수물 및 산 클로라이드 (산 클로라이드)의 비교. 아마도 최근에 아실 클로라이드에 대한 연구를 완료했으며 아실 클로라이드로 산 무수물에 동시에 작용하고 있습니다.
- 산 무수물에 대한 모든 것을 처음부터 배우려고하는 대신 일부 변형 된 염화물로 생각하는 것이 훨씬 쉽습니다. 이것이 제가이 섹션에서 취하고 싶은 태도입니다.
- 그림의 색상 코딩을 면밀히 검사하면 산 무수물 및 산 클로라이드의 구조를 비교하는 데 도움이됩니다.
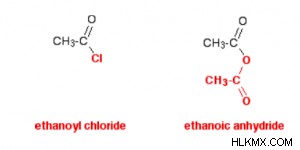
바닥 적색 그룹은 에타노 닉 무수물 반응에서 결코 깨지지 않습니다. 염화 아실의 염소 원자와 마찬가지로 여러면에서 단일 원자처럼 보입니다. 아실 클로라이드는 종종 염소를 다른 물질로 대체하여 반응합니다. 에탄일 클로라이드 사용 예를 들어 첫 번째 반응은 다음과 같습니다.

염화상 수소가 생성되며, 이는 나중에 조합의 다른 성분과 반응 할 수 있습니다. 무수물은 반응을 늦추지 만, 주요 차이점은 아세트산이 클로로 라이드 대신 부산물로 형성된다는 것입니다.
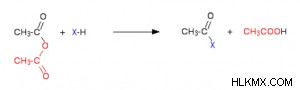
이것은 염화 수소와 마찬가지로 다른 환경 요소와 계속 상호 작용할 수 있습니다. 물, 알코올 및 페놀, 암모니아 및 아민 및 기타 물질은 염화 아실 및 무수물 반응에 참여합니다. 이러한 각각의 특정 상황에서, 활성 고독한 쌍 (산소 또는 질소)을 갖는 고도로 전기 음성 요소가 존재한다.
산 무수물의 화학적 특성
-ocor 그룹을 변화시킴으로써, 산 무수물은 친 핵성 치환 반응을 겪는다. -OCOR 그룹과 비교하여 CL 원자의 전기 음성이 높을수록 산 염화물보다 반응성이 떨어집니다.
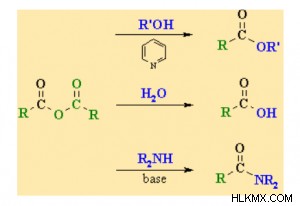
여기서 r, r | 및 r 2 Alkane 그룹입니다.
탄산 산의 형성
탄소 산은 이산화탄소와 물이 반응 할 때 생산됩니다. 탄산의 화학적 공식은 다음과 같습니다.
Co 2 (g) + h 2 o → H 2 Co
이산화탄소는 물과 상호 작용하여 수소를 방출하여 산성 탄산산 또는 H 2 를 형성 할 수 있습니다. Co 3 . 산성 비가이 과정의 결과입니다. 개울, 강 및 바다의 pH를 변경하는 데 중요합니다. 위의 방정식은 공기 중 이산화탄소의 양을 증가 시키면 생명을 위협하는 이산화탄소를 생성한다는 것을 보여줍니다. 우리가 현재 일하고있는 주요 문제는 이것입니다.
황산의형성 :
황제 및 물은 황산을 형성하기 위해 결합됩니다. 화학적으로 설명 할 것입니다. 황산은 황산이 형성 될 때 형성됩니다. 황산은 트산 사이드 가스와 물이 상호 작용할 때 형성됩니다.
so
황화 이산화황이 공기 중의 산소와 결합 될 때 삼산화황이 형성됩니다. 비가 오면 물과 반응하면 산성비가 형성됩니다. 이것들은 생태계에 매우 부정적인 영향을 미칩니다.
아세트산 무수물 에 대해 자세히 알아보십시오
- acetic anhydride는 산 무수물의 가장 간단한 예 중 하나입니다. 화학적으로, 아세트산 무수물이라고도 불리는 아세트산 무수물에 대한 공식은 (ch 3 입니다. CO)
2 O. 종종 ac 2 이라고합니다 O, 그것은 카르 복실 산의 가장 쉽게 분리 된 무수물입니다. 유기 화합물의 합성에서 일반적인 시약입니다. 그것은 공기 중 수분과 반응하여 아세트산을 생산하고 강한 아세트산 냄새를 갖는 흰색 액체입니다. - 아세트산은 아세트산 무수물을 생성하기 위해 800 ℃에서 탈수 될 수있다. 대안으로, 아세트산 무수물 및 염은 염화물이 아세트산 나트륨과 같은 아세트산 염과 반응 할 때 생성된다. 아세트산 무수물 공식은 또한 다음과 같이 설명 할 수있다
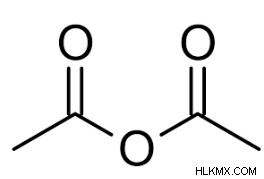
아세트산 무수물의 특성
- iupac 이름 :acetic anhydride
- 분류 :유기산 무수물
- 가용성 :물, 벤젠
- 공식 :c 4 H 6 o 3
- 아세트산 무수물의 밀도 :1.08 g/cm³
- 아세트산 무수물 몰 질량 :102.09 g/mol
- 비등점 :139.5 ° C
아세트산 무수물 밀도는 1.072 g/ml이다. 물은 아세트산 무수물을 흡수 할 수 없습니다. 아세트산 무수물 밀도는 물보다 약간 높으며 밀도는 0.999g/ml입니다. 0보다 작고 합리적으로 높은 산도를 갖는 아세트산 무수물의 PKA 값은 -6.9입니다. 제로 PKA 값보다 낮은 것은 강산에서 발견됩니다. 산은 더 강력하고 PKA 값이 낮을 수 있습니다. 아세트산 무수물 몰 질량은 102.09 g/mol 인 것으로 밝혀졌습니다. 물의 몰 질량은 약 18.015 g/mol입니다. 따라서, 아세트산 무수물 몰 질량은 물의 거의 5 배입니다.
아세트산 무수물의 구조 및 특성
대부분의 산 무수물과 마찬가지로, 아세트산 무수물은 비평선 형태의 가단성 분자입니다. 2 개의 카르 보닐 산소 사이의 쌍극자 반발과 비교하여, 중심 산소를 통한 PI 시스템을 결합하면 비교적 겸손한 공명 안정성을 제공한다. 이상적인 평면이없는 입체 형태 사이의 결합 회전에 대한 에너지 장벽이 상대적으로 적습니다.
아세트산 무수물의 사용
- 아세트산 무수물은 주로 상업적으로 중요한 생성물로 이어지는 아세틸 화에 사용된다.
- 주요 용도는 셀룰로오스를 셀룰로오스 아세테이트로 전환시키는 것입니다. 셀룰로오스 아세테이트는 담배 필터를 제조하는 데 사용되며 사진 필름 및 기타 코팅 된 재료의 빌딩 블록입니다.
- 이 과정에서 살리실산이 아세틸 살리실산이라고도하는 아스피린으로 전환되는 방식과 유사 하게이 과정에서 사용됩니다.
- 강력하고 내구성있는 목재를 생산하기 위해 Autoclave 함침 및 후속 아세틸 화에 의해 활동 수정 자로 사용됩니다.
- acetic anhydride는 불법 마약 헤로인 및 메타 Qualone의 제조에서 아세틸 화제로 사용되는 1 차 화학 물질입니다.
유기산 무수물
- 유기 화학 물질 인 산 무수물은 유기산 무수물로 알려져 있습니다. 동일한 산소 원자에 부착 된 2 개의 아실기가있는 물질을 산 무수물이라고합니다. 포뮬라의 카르복실산 무수물 (RC (O)) 2 O는 부모의 산이 카르복실산 인 전형적인 유기산 무수물이다. 이러한 형태의 대칭 무수물은 부모 카르 복실 산의 이름으로 산 단어를 대체함으로써 표시됩니다. 따라서 (CH3CO) 2O를 아세트산 무수물이라고도합니다.
- 혼합 (또는 비대칭 적) 산 무수물은 공식 무수물 아세트산과 같은 두 개의 상이한 카르 복실 산 사이에 반응이 있는데 알려져있다. 설페닉 또는 포스 폰산과 같은 다른 형태의 유기산은 또한 무수물에서 하나 또는 두 아실 그룹의 공급원으로서 작용할 수있다. 인산과 같은 무인산은 무수물에서 아실 그룹의 한 공급원으로서 작용한다.
기억해야 할 핵심 사항
- 산성 무수물은 유기 화학에 널리 사용됩니다.
- 많은 제품이 도움을 받아 제약, 산업 화학 물질, 폭발물, 향수가 있습니다.
- 에스테르는 알코올을 아세틸화하여 만들어집니다.
- 아스피린 (아세틸 살리실산)의 합성.
- 헤로인은 탈 아세틸 화 모르핀으로 만들어집니다.