화학 학생들은 일반적으로 화학 반응의 산물을 예측하는 데 어려움이 있습니다. 그러나 실제로는 프로세스가 점차 쉬워집니다.
첫 번째 단계 --- 관련 반응 유형을 식별하는 것은 일반적으로 가장 어렵습니다. 학생들이 만나는 주요 반응 유형은 변위, 산-염기 및 연소입니다. Tell-Tale 표시가 알려져 있으면 쉽게 식별됩니다. 변위 반응은 황산나트륨과 같은 양이온 및 음이온을 갖는 2 개의 이온 성 화합물을 포함하며, 여기서 나트륨 (Na?)은 양이온이고 황산염 (SO? ²?)은 음이온이다. 이온 성 화합물은 항상 금속과 비금속 또는 다 원소 (다중 원자) 음이온으로 구성됩니다. 분해 반응은 단일 화합물이 둘 이상의 화합물로 파괴된다. 산-염기 반응은 산 (HCl과 같은“H”로 시작하는 화학적 공식으로 확인)을 포함해야합니다. 연소 반응은 수소 또는 탄화수소 (예 :CH?)가 산소 (O?)와 반응하는 것을 포함합니다.
변위 반응
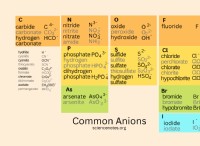
반응과 관련된 화합물의 양이온 및 음이온을 확인하고 전하를 식별하십시오. 필요한 경우 Penn State University 웹 사이트에서 제공되는 것과 같은 양이온 및 음이온 테이블을 참조하십시오 (자료 참조). 예를 들어 염화나트륨 (NaCl)은 나트륨 이온 (Na?)과 클로라이드 이온 (Cl?)으로 구성됩니다.
두 반응물의 음이온을 교환하여 반응의 생성물을 결정합니다. 변위 반응은이 일반적인 형태를 취합니다 :
AB + CD? ad + cb
따라서 염화나트륨 (NaCl)과 질산은 (Agno?) 사이의 반응을 위해 :
NaCl + Agno? ? 나노? + agcl
제품이 용해되는 지 여부를 결정하십시오. 이를 위해서는 Southern Methodist University의 "용해도 규칙"목록을 언급해야 할 수도 있습니다 (자원 참조). 2 단계의 예에서 나노? 용해성이므로 솔루션이 남아 있지만 AGCL은 불용성이며 침전물을 형성합니다.
각 유형의 원자가 반응 화살표의 각 측면에 동일한 숫자로 존재하는지 확인하기 위해 필요에 따라 반응물 및 생성물 앞에 계수를 추가하여 반응이 균형을 이루는지 확인하십시오. 2 단계의 예에서, 방정식의 왼쪽은 1 Na, 1 Cl, 1 Ag, 1 N 및 3 O를 함유하고; 오른쪽에는 1 NA, 1 CL, 1 Ag, 1 N 및 3 O가 포함되어 있습니다. 따라서 반응은 균형을 이룹니다.
산-염기 반응
산성 화합물 (공식에 H? 함유)과 기본 화합물 (보통 수산화물, OH?)을 식별합니다.
일반적인 반응에 따라 제품을 결정하십시오.
산 +베이스? 소금 + 물
예를 들어, 염산 (HCL)이 수산화 나트륨 (NAOH)과의 반응은 염화나트륨과 물을 생성합니다 :
HCL + naoh? naCl + h? o
용해도 규칙을 참조하여 소금이 용해성 또는 불용성인지 결정하십시오.
반응의 균형. 이 경우 2 단계의 반응은 이미 균형을 이룹니다.
연소 반응
- 양이온 및 음이온 표 (자원 참조)
- 용해도 규칙 (자원 참조)
연료 (탄소 및/또는 수소의 공급원) 및 산화제 (산소 공급원)를 결정하십시오 (자원 참조). 연소가 공기 중에서 수행되는 경우, 산화제는 분자 산소 (O?) 인 것으로 가정합니다. 아산화 질소 (n? o)와 같은 다른 산화제는 가능하지만 특별한 반응 조건이 필요합니다.
이 일반적인 반응을 가정하여 제품을 예측하십시오.
연료 + 산화제? 공동? + h? o
예를 들어, 프로판 (C? H?)은 O와 결합됩니다. 연소 중에 :
c? h? + o? ? 공동? + h? o
반응의 균형. 2 단계의 예제 :
c? h? + 5 o? ? 3 공동? + 4 h? o