핵심 개념
이 튜토리얼에서는 금속 및 비 메탈 에 소개됩니다. 주기율의 요소와 그 속성에.
다른 기사에서 다루는 주제
- 금속, 비금속 및 금속성의 특성
- 이온 결합 대. 공유 결합
- 전자 친화력
- 전기 음성
- 금속 결합
금속
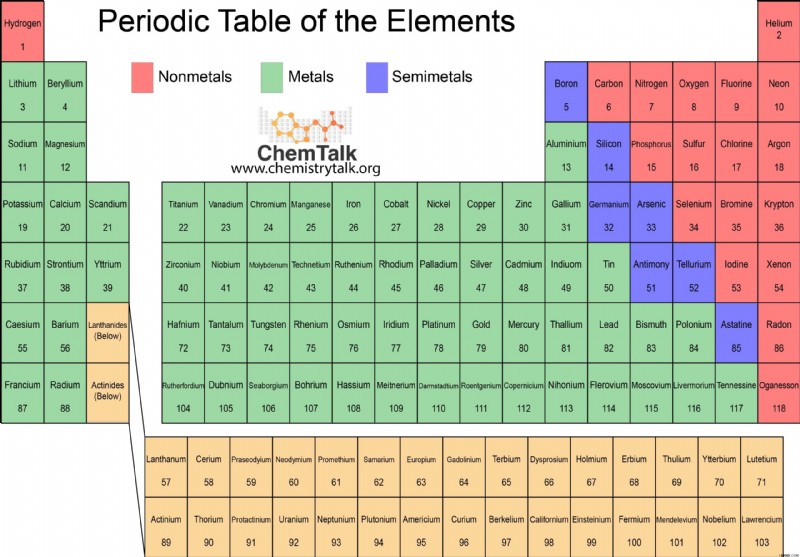
주기적인 요소 테이블의 대부분의 요소는 자신을 금속으로 분류합니다. 주기율표 금속에는 붕소, 실리콘, 비소, 텔 루륨 및 아스타틴의 5 가지 요소 사이에서 실행되는 지그재그 라인의 왼쪽에 배치됩니다. 선에 또는 그 왼쪽에 떨어지는 요소 (붕소, 실리콘, 게르 니움, 비소, 텔루 루륨, 안티몬 및 폴로늄)는 메탈 로이드 또는 반 세중으로 분류 될 수 있습니다. 이것은 그들이 금속과 비금속의 특성을 가지고 있음을 의미합니다.
금속의 예
주기율표의 일부 잘 알려진 금속은 다음과 같습니다. 철, 납, 알루미늄,은, 칼슘 및 나트륨은 실온에서 고체로 나타납니다. 금속으로 분류되는 수은은 유동성 테이블의 유일한 금속입니다. 주기적인 테이블 금의 백 18 개의 금속 중에서 금은 가장 가단합니다. 그렇기 때문에 보석은 결코 100% 순수 금이 될 수 없거나 그렇지 않으면 일상적인 마모와 용기를 견딜 수 없습니다.
금속의 특성
- 모든 금속은 용융점이 다릅니다 그러나 일반적으로 모든 금속은 녹는 점과 비등점이 높습니다.
- 대부분의 금속은 고체 로 존재합니다 실온에서 수은은 실온에서 액체로 존재하기 때문에이 규칙의 유일한 예외입니다.
- 금속은 lustrous 입니다 본질적으로, 그들의 표면이 반짝임을 의미합니다. 구리는 매우 광택있는 금속입니다.
- 금속은 일반적으로 비금속보다 밀도가 높습니다.
- 일반적으로 금속은 매우 가단성 입니다 , 그들은 얇은 시트로 구타를 당할 수 있음을 의미합니다. 순수 금은 가장 가단성 요소입니다.
- 금속은 연성 입니다 이것은 그들이 얇은 시트로 굴릴 수 있음을 의미합니다.
- 마지막으로, 금속은 도체 입니다 열과 전기의.
금속과 그들의 전하
금속은 주기율표의 왼쪽에 놓여 있기 때문에 종종 낮은 이온화 에너지와 낮은 전자 친화도를 갖기 때문에 전자가 상대적으로 쉬운 전자를 제공하여 금속이 양이온이되도록합니다. 주요 그룹 금속은 일반적으로 그룹 번호와 동일한 요금을 형성합니다. 그룹 1A와 같은 리튬 및 나트륨의 금속은 +1의 전하를 가지며, 마그네슘 및 칼슘과 같은 그룹 2A의 금속은 +2 전하를 갖는다.
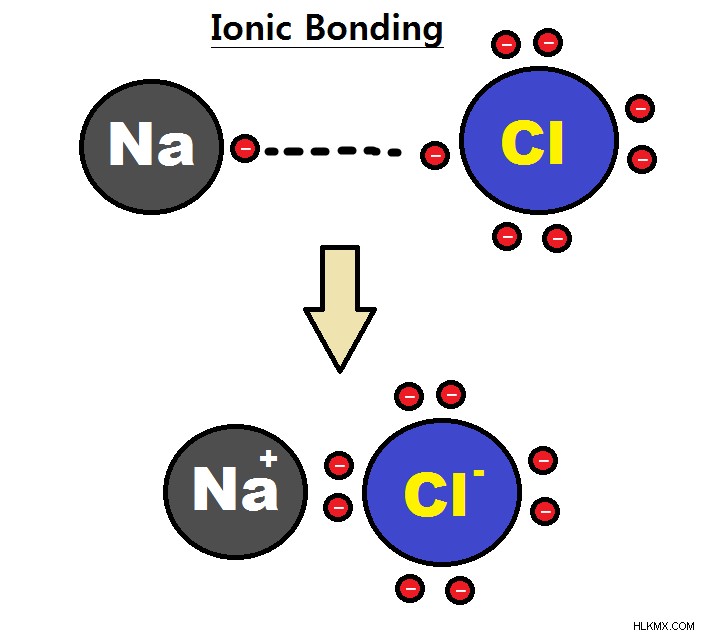
전이 금속을 따르는 금속은 s를 잃을 수 있습니다. 궤도 및 p 궤도 전자 및 그룹 번호와 동일한 궤도 전하 또는 p 을 잃을 수 있습니다. 궤도 전자와 두 s를 유지하십시오 궤도 전자; 그룹 4A에서 주석 및 리드와 같은 금속은 +4 또는 +2 전하를 형성 할 수 있습니다. 이들 금속이 다른 비 메탈과 결합 할 때 이것은 전자의 전달이 한 종에서 다른 종으로 발생하는 이온 결합으로 알려져있다.
비 메탈
비금속은 주기율표에서 요소의 작은 부분을 차지합니다. 주기율표에서, 비금속은 원소 붕소, 실리콘, 비소, 텔 루륨 및 아스타틴 사이에 실행되는 지그재그 라인의 오른쪽에 놓여 있습니다. 비금속에는 또한 메탈 로이드의 왼쪽에있는 수소가 포함됩니다. 이러한 요소 중 다수는 생물학적 역할을합니다. 생물은 탄소 나 수소와 같은 거의 전적으로 비 메탈로 구성됩니다.
비 메탈의 예
주기율표에는 17 개의 비금속이 있지만 몇 가지 일반적인 예에는 산소와 질소가 포함되어있는 산소와 질소가 포함되어 있으며, 이는 우리가 호흡하는 대부분의 공기를 설명하고 네온이나 화학 화합물 이산화탄소와 같은 몇 가지 다른 가스를 포함합니다. 고귀한 가스로도 알려진 비 결합 헬륨, 네온, 라돈, 아르곤, 크 르네튼, 크립톤 및 오가 네슨은 비 메탈의 덩어리를 구성합니다.
비 메탈의 특성
- 대부분의 금속은 가스 에서 발견됩니다 상태이지만 일부는 고체 또는 액체 상태에서 찾을 수 있습니다. 액체로 발견 될 수있는 브롬처럼.
- 일반적으로 비 메탈은 반짝이는 것이 아닙니다 또는 화려 함.
- 비 메탈은 낮음 를 가지고 있습니다 용융 및 끓는점.
- 비금속에는 종종 저밀도 가 있습니다 .
- 금속과 달리 비 메탈은 종종 매우 가난한 도체 입니다 열과 전기의.
비 메탈 및 그 청구
비금속은 높은 이온화 에너지와 높은 전자 친화도를 가지므로 전자를 쉽게 얻을 수 있지만 훨씬 더 많은 노력으로 그것들을 잃어 음이온으로 분류됩니다. 그들은 가장 가까운 고귀한 가스와 같은 수의 전자를 가질 때까지 전자를 계속 얻을 것입니다. 그들의 요금은 그룹 번호에서 8으로 분류 될 수 있습니다. 따라서 그룹 7A의 비 메탈에는 -1 충전, 그룹 6A 양식 -2 충전 및 그룹 5A 양식 -3 요금이 있습니다. 그룹 8A의 고귀한 가스는 이미 옥셋을 가지고 있으므로 결합을 형성하는 것을 주저합니다. 두 개의 비금속 결합이라면 공유 결합을 형성합니다. 이들은 전자 쌍이 원자에 의해 공유 될 때 발생합니다.