화학에서, 두더지는 반응물을 화학량 론적 방정식의 생성물과 관련시키는 수량이다. 모든 물질의 두더지는 해당 물질의 6.02 x 10^23 입자 (일반적으로 원자 또는 분자)와 같습니다. 주어진 요소의 경우, 하나의 두더지의 질량 (그램)은 주기성 테이블의 질량 수에 의해 주어진다; 분자의 "몰 질량"은 분자 내의 요소의 몰 질량의 합의 합입니다. 주기성 테이블을 사용하여 그램과 두더지 사이를 전환하는 원소 및 분자의 몰 질량을 결정하는 것은 간단합니다.
요소의 어금니 질량 결정
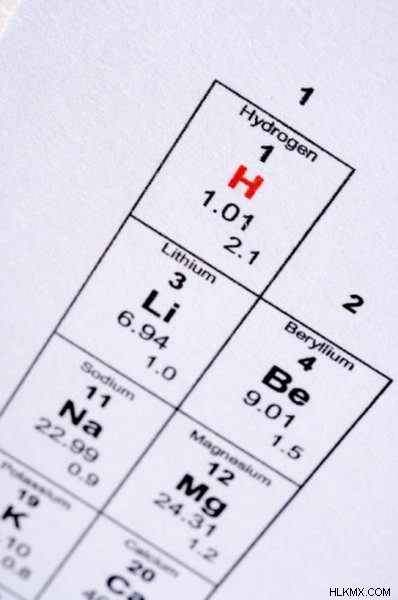
주기율표에서 리튬 (li) 요소를 찾으십시오. 리튬의 원자 수는 3이며, 한 원자의 핵에서 양성자의 수를 나타냅니다.
리튬의 질량 수는 6.94이며, 하나의 원자의 핵에서 양성자 및 중성자의 합을 나타냅니다.
.질량 수는 1 몰의 리튬의 질량 (그램)과 동일합니다. 이것은 리튬의 몰 질량입니다.
화학 화합물의 분자 질량 결정
이산화탄소의 분자 질량 (화학식 CO2)을 결정하십시오. 주기율표에서 탄소와 산소를 찾으십시오.
각각 12.01과 16 인 주기적 테이블의 탄소와 산소의 질량에 주목하십시오.
주기율표에서 1 개의 탄소 원자와 2 개의 산소 원자의 질량을 추가하십시오 :12.01 + 2 (16) =44.01 두더지 당
.질량에서 두더지로 변환
600 그램의 물 (H2O)에서 물의 몰수를 계산하십시오. 주기율표에서 수소와 산소를 찾으십시오.
그램을 두더지와 관련된 다음 방정식을 설정하십시오.
X 몰스 H2O =(1 몰 h2O/18 그램 H2O) X (600 그램 H2O)
600 그램의 H2O에 3.33 몰의 H2O가 있음을 알기 위해 2 단계에서 방정식을 해결하십시오.
.