핵심 개념
수소 결합 생물학적 시스템에서 구체적으로 많은 분자 작용을 담당하는 필수 분자간 힘이다. 이 튜토리얼에서는 수소 결합, 예제, 그리고 화학 및 생물학에서 왜 중요한지를 배울 것입니다.
다른 기사에서 다루는 주제
- 분자간 힘
- 이온 다이폴 세력
- 이온 결합 대 공유 결합
- 수소
어휘
- 분자간 힘 : 동일한 물질 내 상호 작용 분자 사이의 힘. 이것들은 분자 내 힘과 다르며, 분자 내 원자 사이에 존재하는 힘입니다.
- 이온 결합 : 반대로 하전 된 두 이온 사이의 정전기 인력으로 인해 형성되는 본드. 예 :Na와 Cl은 이온 결합을 형성하여 naCl을 생성합니다
- 공유 본드 : 두 개의 원자 공유 전자 공유로 인해 형성되는 결합. 예 :Co
- 쌍극자 : 전자의 자연 이동으로 인한 원자의 부분 전하는 그렇지 않으면 중성 분자에서 부분 양성 및 음전하를 초래합니다.
수소 결합이란 무엇입니까?
수소 결합은 한 분자의 수소와 다른 분자의 전기 음성 원자 사이에서 발생하는 분자간 힘의 한 유형입니다. 구체적으로, 이들은 수소를 함유하는 화합물과 다음 원자 중 하나 이상의 산소, 불소 또는 질소 사이에서만 발생한다. 수소 결합이 이러한 분자에서만 발생한다는 것을 기억하는 영리한 방법은“화학은 fon (재미)입니다.”입니다. 수소 결합은 세 가지 유형의 분자간 힘 중 가장 강력합니다.
수소 결합은 공유 결합과 동일합니까?
아니요 . 수소 결합은 inter 입니다 공유 결합은 인트라 인 분자력 분자력. 이러한 결합은 종종 많은 공유 화합물에 존재하지만 공유 결합과는 매우 다릅니다. 이러한 유대는 강력하지만 공유 결합만큼 강하지 않으며 종종 끊임없이 파손되고 개혁됩니다.
수소 결합은 어떻게 발생합니까?
이들 결합은 수소가 하나의 분자 및 불소, 산소 또는 질소에서 양성 쌍극자를 형성 할 때 다른 분자에서 음성 쌍극자를 형성 할 때 발생한다. 수소의 양성 쌍극자는 전기 음성 원자의 음성 쌍극자에 끌려서 두 분자 사이의 인력을 만듭니다.
수소 결합의 예
수소 결합의 일반적인 예를 볼 때 수소 결합을 이해하면 더 간단 해집니다.
물에서의 수소 결합
물에서의 수소 결합은 종종 물의 많은 특성에서의 중요성으로 인해 이러한 결합의 가장 일반적인 예입니다. 물에서, 수소 결합은 한 분자의 산소와 다른 분자의 수소 사이에 발생합니다.

이러한 결합은 응집력 (물 자체에 달라 붙는 능력), 접착력 (물이 다른 분자에 달라 붙는 능력), 표면 장력, 높은 비열 및 용매 특성과 같은 물에서 중요한 특성을 초래합니다.
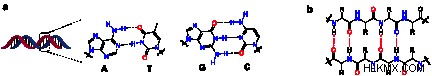
DNA에서의 수소 결합
수소 결합은 DNA의 구조와 그 특성의 이유이므로 생물학에서 매우 중요합니다. 이들 결합은 뉴클레오티드 염기 쌍 사이의 두 가닥의 DNA 사이의 연결을 담당한다. 아데닌과 티민은 이들과 시토신과 구아닌 사이에 두 개의 수소 결합을 형성한다. 이 결합은 DNA를 이중 나선 형성으로 유지합니다. 또한, 이러한 결합은 결합의 강도가 가닥을 함께 유지하기 때문에 DNA의 복제에 중요하지만, 약간의 힘으로 부러 질 정도로 약해서 복제 할 때 가닥을 분리 할 수 있습니다.
.
이러한 결합은 또한 DNA와 많은 단백질이 최적의 pH 및 온도를 갖는 이유입니다. pH가 낮 으면, 이것은 고농도의 H 이온이 있음을 의미합니다. 이들 이온은 반응성이기 때문에, 이들은 수소 결합을 깨고 전기 음성 원자에 결합하여 대체 할 수있다. pH가 높을 때 동일하게 발생할 수 있습니다. 이는 높은 농도의 OH 이온이 있음을 의미합니다. 음성 산소는 하이드로겐에 매력적이며, 이는 수산화물의 산소와 DNA 염기 쌍의 수소 사이에 결합 파괴 및 새로운 결합 형성을 초래할 수 있습니다. pH에 대해 자세히 알아보십시오.
이러한 결합은 온도에 의해서도 깨질 수 있습니다. 시스템이 가열되면 분자는 더 빨리 움직이기 시작하고 수소 결합을 파괴하기에 충분한 에너지를 얻습니다. 이러한 결합은 DNA 및 많은 단백질의 구조에 필수적이므로 생물학적 시스템에 해로운 변화를 초래할 수 있습니다.
약물에서의 수소 결합
수소 결합은 약물의 구성을 고려할 때 필수적이며 신체에서의 상호 작용 방법. 구체적으로, 약물이 특정 표적 분자에 작용하는 경우, 기능을 변화시키기 위해 어떤 방식으로 분자에 결합해야한다. 이러한 결합이 발생하기 위해, 수소 결합은 약물이 분자의 활성 부위에 단단히 결합 할 수있게하므로 필수적이다. 이것은 또한 수소 결합이 단단하면서도 가역적 결합이 발생할 수있는 효소-하류 상호 작용에서도 볼 수 있습니다.
수소 결합 및 끓는점
앞에서 논의한 바와 같이, 수소 결합은 가장 강력한 분자간 힘이다. 결과적으로 물질의 압력 또는 온도가 증가하면 이러한 결합에 도전합니다. 이러한 유대는 강력하기 때문에 Van der Waal 또는 Dipole-Dipole Forces를 깨는 것보다 이러한 유대를 깨는 데 더 많은 에너지가 필요합니다.
.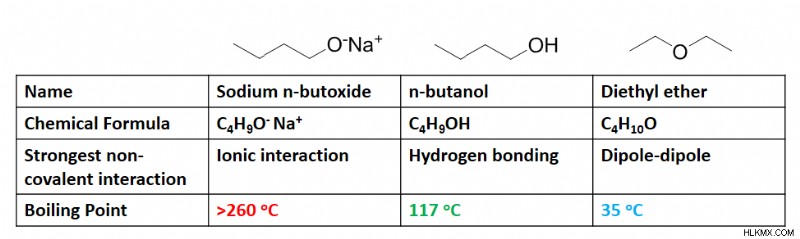
예를 들어,이 표는 화합물에 수소 결합이 존재할 때 발생하는 끓는점의 극적인 변화를 나타냅니다. 이 경우, 비등점은 분자 구조에 약간의 변화만으로 트리됩니다. 그것들은 위에서 볼 수 있듯이 공유 또는 이온 성 결합보다 여전히 약하지만, 강도가 추가 안정성을 허용하여 끓는점의 극적인 변화를 초래한다는 것은 분명합니다.
.추가 읽기
- 표면 장력 및 증기 압력
- 비열은 무엇입니까?
- 공식 요금
- Gibb의 자유 에너지는 무엇입니까?