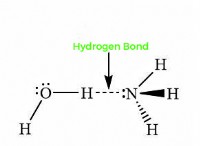
핵심 개념
이 튜토리얼에서는 다른 산 기본 이론을 비교하고 대조합니다. Arrhenius와 Bronsted Lowry 이론에 소개됩니다 , Arrhenius 산과 Bronsted-Lowry Acid (Bronsted Acid)의 아이디어.
Lewis Acids &Bases 튜토리얼을 확인하여 Lewis 이론에 대해 알아보십시오!
다른 기사에서 다루는 주제
- 산-염기 화학 pH의
- 정의
- 강산 및 염기
- 산 및 염기의 특성
- 순 이온 방정식
- 일반적인 이온 효과
- 산 염기 중화 반응
- KSP - 용해도 제품 상수
산 기본 이론은 무엇입니까?
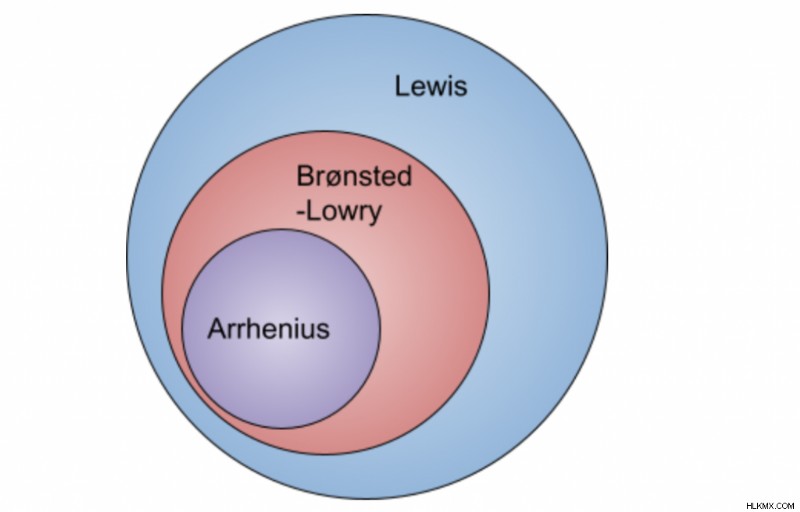
화학에는 3 가지 다른 산 기초 이론이있다. 이러한 각 이론은 산성 반응으로 자격이되는 것에 대한 자체 정의를 가지고 있습니다. 아래 각 이론의 다른 자격을 배우겠습니다!
Arrhenius 산 및 염기
이 이론은 산과 염기를 물에 분리 할 수있는 화합물로 정의하여 이온 상대 (예 :HBR → H + BR)로 분해됩니다.
.
Arrhenius acid 용액에서 H+ 이온을 생성하는 화합물입니다. 질산, HNO 3 , Arrhenius 산의 예는 h 를 분리하고 생성하기 때문에 Arrhenius 산의 예입니다. 및 NO
h-a (aq) → h (aq) + a (aq)
반면, Arrhenius베이스는 용액에서 OH 이온을 생성하는 화합물입니다. 수산화 칼륨 인 Koh는 k and OH 를 분리하고 생성하기 때문에 Arrhenius베이스입니다. 이온.
b-oh (aq) → b (aq) + Oh (aq)
또한, H와 OH 이온이 함께 반응하여 물을 형성하기 때문에 용액 내에서 중화가 발생합니다.
h (aq) + Oh (aq) → h 2 o ( l )
Arrhenius 이론은 H 또는 OH 이온이 산 또는 염기로 표시되어야한다고 말하기 때문에 세 가지 이론 중 가장 특이성을 가지고 있습니다. 그러나 이것은 다른 이론에서는 사실이 아닙니다. 더 많은 화합물을 포함하는보다 일반적인 이론-청동 가운 산의 개념
산 및 염기의 이러한 정의는 물을 함유하지 않는 용액을 분석하는 데 사용될 수 있습니다. 화합물이 양성자를 얼마나 잘 받아들이거나 기부 할 수 있는지와 관련이 있습니다.
Bronsted-Lowry Acid, 일명 Bronsted Acid는 양성자 공여체이며, 이는 양성자를 방출 할 수 있음을 의미합니다. 산이 용액에 분리되면 H+ 수율이 증가합니다. 다시, 질산, hno 3 , h+를 분리하고 생성하기 때문에 산으로 표시 될 수 있습니다. 및 NO
h-a (aq) → h (aq) + a (aq)
Bronsted Lowry Base, 일명 Bronsted Base는 양성자 수용체입니다. 염기가 분리되면 물에서 양성자를 가져와 용액에서 OH 이온을 생성합니다. nh 3 도 마찬가지입니다 산 또는 염기? 암모니아, nh 3 , 그것은 NH 4 의 생성물을 형성하기 위해 물에서 양성자를 가져 가기 때문에베이스의 예입니다. 그리고 오.
b (aq) + h 2 o ( l ) → b-h (aq) + Oh (aq)
이 이론에서 물은 산 또는 염기 일 수 있습니다. 이것은 H 3 를 형성하기 위해 양성자를 받아 들일 수 있기 때문입니다. o 또는 양성자를 기증하여 OH를 형성하십시오. 화합물이 브론 스테드-로운 산이나 염기로 작용할 수있을 때, 양서류 이라고합니다. .
브론 스테드 끈 이론은 Arrhenius 이론에 추가됩니다. H와 OH 이온을 생성한다는 일반적인 아이디어는 동일하지만,이 이론은 더 일반적이며, 이는 더 많은 화합물이 산 또는 염기로 표지 될 수있게한다; 예를 들어, 염기는 수산화물 이온을 형성하기 때문에 OH (Arrhenius 이론에 있어야 함)를 포함 할 필요가 없습니다.
이 이론은 특이성이 가장 적기 때문에 광범위한 산과 염기를 선택할 수 있습니다. 루이스 산은 전자 쌍 수용체이고, 루이스베이스는 전자 쌍의 공여체입니다. 양성자 또는 수소에 대한 언급은 없어서 더 많은 화합물 이이 범주에 적합 할 수있는 기회를 만듭니다. 루이스 이론에 따르면 루이스베이스는 루이스 산과 공유되거나 사용되는 한 쌍의 전자를 기부한다고합니다. 더 자세하게 설명하려면 Lewis Acids &Bases 튜토리얼을 읽으십시오!
h-a (aq) + h 2 o ( l ) → h 3 o (aq) + a (aq) 청동 고유 산 및 염기
h-a (aq) + h 2 o ( l ) → h 3 o (aq) + a (aq) 루이스 산 및 기본 이론
추가 읽기