핵심 개념
이 튜토리얼에서는 중요한 생화학 적 특성과 함께 20 개의 아미노산 구조에 대해 배우게됩니다.
다른 기사에서 다루는 주제
- 단백질 및 아미노산
- ATP는 무엇입니까?
- 아미노 기능 그룹
아미노산
아미노산은 폴리펩티드 및 단백질의 빌딩 블록입니다. 그것들은 우리 몸의 중요한 부분이며 단백질 합성과 같은 많은 과정을 지원합니다. 각각의 아미노산에서, 아미노기 및 카르 복실 산기가 탄소에 부착된다. 그러나 아미노산은 R 그룹의 조성에 기초하여 서로 다릅니다.
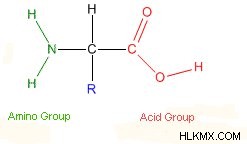
20 개의 아미노산은 모든 단백질을 구성합니다. 반복하려면 구조의 유일한 차이점은 R 그룹입니다. 가장 단순하거나 가장 작은 아미노산은 글리신입니다. 특히, 글리신은 수소가 R 그룹으로서 수소를 갖는다. 그들의 다른 측쇄는 전하, 소수성 (물과 반응하는 방법) 및 극성으로 분류됩니다. 결과적으로,이 세 가지 특성은 폴리펩티드 및 단백질 내에서 주변 환경과 상호 작용하는 방식에 영향을 미칩니다. 이것은 또한 단백질의 3D 구조 및 특성에 영향을 미칩니다.
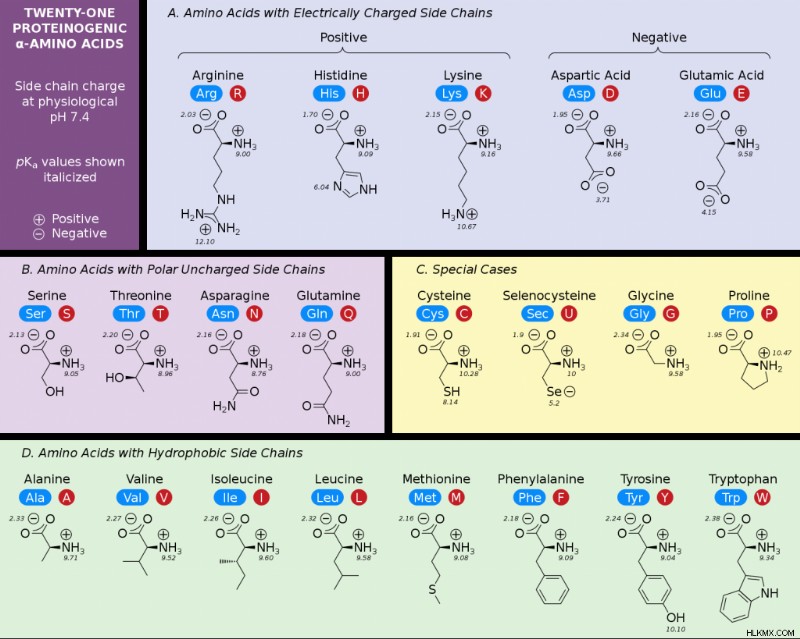
아미노산 차트
아래 차트에는 21 개의 아미노산이 있습니다. 그러나 셀레 노시 슈타인은 단백질에있는 20 개의 필수 아미노산의 일부가 아닙니다.
아미노산 측쇄
아미노산 소수성 측쇄
아래의 아미노산은 모두 사이드 체인을 가지고있어 소수성으로 만듭니다. 이 속성은 그들을“물을 두려워”하거나 물에 용해시킬 수 없게 만듭니다.
알라닌 (ALA)는 최초의 소수성 아미노산이며 반응성이 낮습니다. 이 속성은 Alanine이 똑같이 유연하고 신축성이있는 길쭉한 구조를 만들 수 있습니다.

발린 (Val)은 우리 몸 안에서 더 간단한 화합물로 분해 될 수 있습니다.

isoleucine (Ile)에 포함 된 단백질의 3 차 구조가 결정될 때 중요합니다.

류신 (Leu)는 신체 내의 더 간단한 화합물로 분해되는 발린과 유사합니다. 그러나 효소의 사용을 통해 저하된다.

메티오닌 (Met) 간에 지방 축적을 방지하고 폐기물과 독소를 해독합니다.
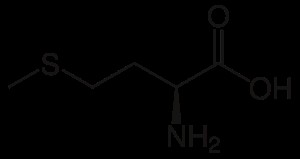
페닐알라닌 (Phe)는 신체 내에서 티로신으로 분해 될 수 있습니다.

Tryptophan (TRP)는 인간의 장에서 분해 될 수 있습니다. 또한 비타민 B3로 전환 할 수 있습니다.

티로신 (TYR)는 또한 우리 몸의 중요한 호르몬의 중요한 선구자입니다. 부신 호르몬 (에피네프린 및 노르 에피네프린), 갑상선 호르몬 (티록신) 및 멜라닌 (모발 및 피부 안료를 담당) 내에 있습니다. 페닐알라닌은 티로신을 생성합니다.

아미노산 중성 측쇄
아래의 아미노산은 모두 극성 중립 인 측쇄를 가지고 있습니다. 이것은 그들의 측쇄가 산성이거나 기본적이지 않음을 의미합니다.
asparagine (ASN)는 우리 몸에서 암모니아 (독성 화학 물질)를 제거 할 책임이 있습니다.

글루타민 (GLN)은 우리 몸에서 가장 풍부한 아미노산이며 여러 기능을 수행합니다. 그것은 우리 몸에서 독성 암모니아와 요소를 조절할 책임이 있습니다. 글루타민이 독성 암모니아를 제거 할 수있는 이유는 카르 복실 측 사슬이 암모니아의 공여체 및 수용자 역할을 할 수 있기 때문입니다 (이것은 우리 몸에서 암모니아의 안전한 수송을 허용합니다).
.
세린 (Ser)는 대사 산물의 생합성에 관여하며 효소의 촉매 기능에서 중요하다.

Threonine (THR)은 박테리아의 반응과 동물의 대사 속도에 있습니다. 그러나 정확한 효과는 아직 결정되지 않았습니다.

아미노산 산성 측쇄
아스파르트 산 (ASP)는 수용성이므로 효소의 활성 부위 근처에있을 수 있습니다.

글루탐산 (GLU)는 아스파르트산과 유사하며 물에 매우 용해됩니다. 
아미노산 염기성 측쇄
아르기닌 (Arg)는 단백질이 우리 몸 안에서 소화 될 때 생산되며 산화 질소로 전환됩니다 (혈관 이완을 담당)
.
히스티딘 단백질 내에서 (그의) 양성자 수용체 및 공여자로서 작용한다. 이 특성으로 인해 히스티딘은 단백질, 탄수화물 및 핵산의 대사에 관여하는 효소로 결합 할 수 있습니다.

라이신 (LYS)는 코엔자임에 결합 효소에있다. 히스톤이 기능하는 방식에 중요한 역할을합니다. 구체적으로, 그것은 특정 유전자의 전사를 변경시키는 히스톤 아세틸 트랜스퍼 라제에 결합한다.
.
특수 사례가있는 아미노산
시스테인 (Cys)는 펩티드 사슬 사이에 이황화 다리를 형성하고 단수 사슬 내에서 루프를 형성 할 수있다.

글리신 (Gly)는 단백질에있을 때 반응하지 않습니다. 세린 (아미노산), 퓨린, 헴 (혈액에서 발견 된 헤모글로빈의 일부) 및 글루타티온 (코엔자임)의 생합성은 모두 글리신을 필요로합니다.
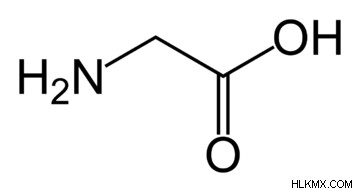
프롤린 (Pro)는 글루탐산으로 만들어졌습니다. 단백질에있을 때는 펩티드 사슬에서 날카로운 구부러진 것이 발생하여 단백질의 최종 구조를 변경합니다

추가 읽기
- 단백질 폴딩
- 당분 해 :분해합시다!
- 세포 신호 란 무엇입니까?