알코올은 탄소 원자와 결합하는 하나 이상의 -OH 그룹을 갖는 화합물이며 의약품 및 많은 산업에서 널리 사용됩니다. 알코올의 탈수는 알켄 및 기타 제품을 형성하기 위해 물을 제거한다는 것을 의미합니다. 알켄을 만드는 가장 좋은 방법은 알코올 탈수입니다. 알코올이 E1 또는 E2 메커니즘을 겪는 과정으로, 이중 결합을 형성하고 물을 잃는 데 도움이됩니다.
알코올 형태의 탈수
알코올의 탈수 반응은이 경우 인산 또는 황산 또는 강산과 함께 고온에서 가열함으로써 시작됩니다.
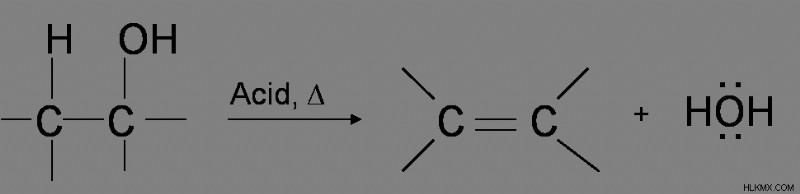
탈수 과정이 충분한 온도에서 수행되지 않으면, 알켄을 형성하는 대신 서로 반응하고 에테르를 형성합니다. 예를 들어,

양서류는 산 및 염기와 반응하는 물질의 특성입니다. 그것들은 산의 존재 하에서 및 염기의 존재하에 산으로서 작용하며, 알코올에는 그러한 특성이 있기 때문에 산과 염기로 작용할 수있다. 예를 들어,
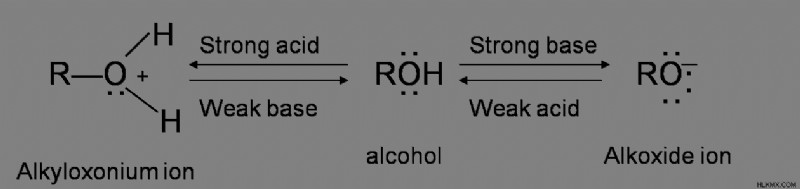
알코올 탈수 메커니즘
모든 유형의 알코올에는 탈수에 대한 메커니즘이 다릅니다. 알코올 탈수의 기본 공정은 알킬 록슨 이온을 형성하는 산 시약으로부터 2 개의 전자를 H+로 기증하는 -OH 그룹을 포함한다. 2 차 및 3 차 그룹은 E1 메커니즘을 겪고, 1 차 알코올 그룹은 E2 메커니즘을 겪는다. 일차 반응은 하이드 록실 산소가 황산으로부터 양성자에 2 개의 전자를 기증하여 알킬 록슨 이온을 생성하는 과정을 겪는다. 2 차 및 3 차 알코올 탈수는 알킬 록슨 이온을 형성하는 -OH 양성자를 형성한다.
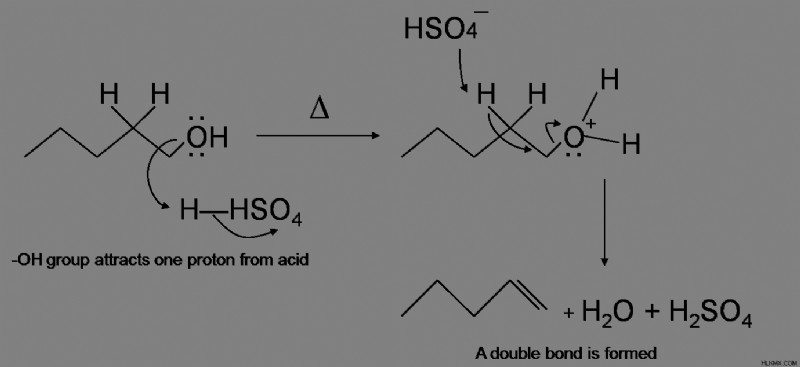
산 촉매를 사용한 알코올의 탈수
알코올 의이 탈수 과정에서, 산 촉매는 농축 인산 또는 농축 황산이다. 농축 황산은 산뿐만 아니라 강한 산화제이기 때문에 까다로울 수 있습니다. 이 때문에 알코올과 반응 할 때 이산화황으로 감소합니다. 또한, 일부 알코올을 이산화탄소로 산화 시키며,이 두 가스는 알켄에서 제거해야합니다.
에테르로의 알코올 탈수
알코올은 엄격하게 제어 된 조건 하에서 에테르를 생성하기 위해 분자간 탈수를 겪을 수있다. 그러나이 반응은 에탄올 메탄올 및 기타 1 차 알코올에서만 효과적입니다. 또한 산업에서 용매로 널리 사용되는 에틸 에테르를 만드는 가장 저렴한 방법입니다.
알코올의 물리적 특성
순수한 형태의 알코올은 실온에서 무색 액체입니다. 메틸, 이소 프로필 및 에틸과 같은 알코올은 과일 냄새를 갖는다. 4-10 개의 탄소 원자를 함유하는 화합물은 아마도 점성 또는 유성 일 가능성이 높습니다. 알코올의 끓는점은 알칸보다 높습니다.
알코올 분자는 물 및 기타 알코올 분자와 수소 결합을 형성 할 수 있기 때문에 알코올과 물은 구별 할 수없는 특성을 가지고 있습니다. 유사하게, 물 분자는 하이드 록실기를 함유하여 다른 물 분자 및 알코올 분자와 수소 결합을 형성 할 수있다. 이 때문에 알코올 분자는 물에 용해되는 경향이 있습니다.
산업에서 알코올의 중요성
에탄올
에틸 알코올은 주로 선사 시대부터 과일 주스의 발효에 의해 주로 생산 되었기 때문에 시간이 지남에 따라 돌아갑니다. 이 과정은 발효 주스를 밀폐 용기에 보관하는 것이었고 겨울 내내 마시는 것이 안전했습니다. 발효 과정에는 설탕과 전분을 더 간단한 성분으로 분해하는 것이 포함되었습니다.
에탄올의 일반적인 이름은 주로 밀, 옥수수 및 보리와 같은 곡물로 생산되므로 곡물 알코올입니다. 이 곡물은 먼저 물에서 끓여서 으깬 생산과 맥아를 포함합니다. 맥아는 전분을 설탕 말토오스로 변환합니다.
이어서, 매싱 공정에서 추출 된 액체를 효모와 함께 배양하여 말토오스를 포도당으로 전환시킨 다음 포도당을 에탄올로 전환시킨다. 에탄올은 배출량이 낮고 옥탄 등급이 높기 때문에 모토의 연료로 널리 사용되었습니다.
메탄올
메탄올에 사용되는 일반적인 용어는 공기가없는 상태에서 목재 칩을 가열하여 메틸 알코올을 만들기 때문에 목재 알코올입니다. 이 작업이 완료되면, 목재로부터의 탄수화물은 메탄올로 분해 된 다음 증기가 응축된다. 메탄올은 고온 및 압력 하에서 일산화탄소의 촉매 반응을 겪습니다.
이 혼합물은 석탄을 부분적으로 연소시킴으로써 물의 존재하에 생성 될 수있다. 메탄올은 주로 산업에서 용매로 사용되며 에탄올보다 더 유해합니다. 대량으로 흡입하면 실명이나 사망을 유발할 수 있습니다.
글리세롤
글리세롤은 글리세린으로도 알려져 있으며 당 및 당밀에서 발효하여 생성 할 수 있습니다. 그것은 제 2 차 세계 대전에서 글리 세릴 트리 니트레이트를 생산하는 데 널리 사용되었습니다. 글리세린은 또한 젤라틴 및 다이너마이트를 폭파하는 데 사용되는 폭발 물질 인 니트로 글리세린을 만드는 데 사용됩니다.
니트로 글리세린은 또한 심장에 혈액의 순환이 좋지 않아 흉통을 완화하기 위해 혈관을 팽창시키고 이완시키는 약물로 사용됩니다. 글리세롤은 플라스틱 화기, 부동액, 수용성 윤활제, 보습제 및 용매로 사용됩니다. 식품, 화장품, 유압 유체, 제약, 비누 및 인쇄 잉크에서 널리 발견됩니다.
결론
알코올은 탄화수소 사슬의 탄소 원자에 부착 된 하나 이상의 -OH 그룹을 함유하는 유기 화합물 그룹이다. 강한 산 촉매로 알코올을 가열하면 알켄과 물을 생산하기 위해 1,2 제거 반응을 겪습니다. 알코올의 상대 반응 순서는 3 °> 2 °> 1 °입니다. 친숙한 알코올 공급원은 에탄올, 이소 프로필 알코올 및 에탄올입니다. 알코올은 다른 화합물로 쉽게 변형 될 수 있고 쉽게 합성되기 때문에 유기 합성에서 중요한 중간체 역할을합니다. 또한 알데히드, 카르 복실 산 및 케톤을 제공하기 위해 산화 될 수 있습니다.