주요 차이 - S n 1 대 S n 2 반응
s n 1 및 s n 도 2는 유기 화학에서 두 가지 유형의 친 핵성 치환 반응이다. 그러나 s n 도 1은 반응 속도가 속도 =k [r-lg]에 의해 발현 될 수있는 비 분자 반응을 나타낸다. s n 와 달리 1, s n 도 2는 이질성 반응을 나타내고, 반응 속도는 속도 =k '[r-lg] [nu]에 의해 표현 될 수있다. 또한 s n 1 경로는 다단계 프로세스이고 s n 입니다 2 경로는 단일 단계 프로세스입니다. 이것이 주요 차이 입니다 s n 사이 1 및 s n 2 반응.
n 1 반응
s n 도 1은 유기 화학에서의 단 분자성 친 핵성 치환 반응을 나타낸다. 메커니즘의 그들의 속도 결정 단계는 단일 분자 종의 분해에 의존한다. 그래서, s n 의 속도 1 반응은 속도 =k [r-lg]에 의해 발현 될 수있다. 또한, s n 도 1은 반응 동안 중간 및 여러 전이 상태를 형성하는 다단계 반응이다. 이 중간체는보다 안정적인 탄수화물이며, 분자의 반응성은 R- 그룹에 의존한다. 다음 그림은 s n 의 메커니즘을 보여줍니다 1 반응.
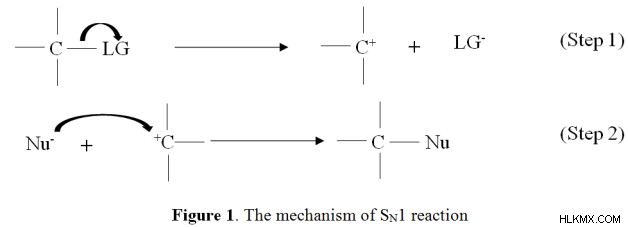
첫 번째 단계에서 leave evels 그룹의 손실 (LG)은보다 안정적인 탄수화물을 형성합니다. 이것은 메커니즘의 가장 느린 단계 또는 속도 결정 단계입니다. 결과적으로, 친핵체는 전자 성 탄소를 빠르게 공격하여 새로운 결합을 형성한다. s n 의 에너지 프로파일 다이어그램 1 바닥에서 주어진 반응은 반응 좌표에 대한 에너지의 변화를 나타냅니다.
또한 s n 의 속도 1 반응은 떠나는 그룹과 알킬 측쇄 부착에 의존한다. R- 그룹의 반응성은 다음과 같이 주문할 수 있습니다.
반응성 순서 :(ch 3 )
s n 1 반응, 속도 결정 단계는 중간 탄수화물을 형성하기위한 잎 그룹의 손실이다. 1 차, 2 차 및 3 차 중 3 차 탄소는 매우 안정적이고 형성하기 쉽습니다. 따라서, 3 차 R 그룹을 갖는 화합물은 s n 의 속도를 향상시킨다. 1 반응. 마찬가지로, 잎 그룹의 특성은 s n 의 속도에 영향을 미칩니다. 1 반응, 더 나은 떠날수록 s n 가 더 빠릅니다 1 반응. 그러나 친핵체의 본질은 s n 에서 중요하지 않습니다. 1 반응 친핵체가 속도 결정 단계에 관여하지 않기 때문에.
n 2 반응
s n 도 2는 유기 화학에서 이질적인 친 핵성 치환 반응을 나타낸다. 이 메커니즘에서, 떠나는 그룹의 분리와 새로운 결합의 형성은 동시에 발생합니다. 따라서, 2 개의 분자 종은 속도 결정 단계와 관련이 있으며, 이는 이질성 친 핵성 치환 반응 또는 SN2라는 용어로 이어진다. SN2 반응의 속도는 속도 =k [r-lg] [nu]에 의해 표현 될 수있다. 무기 화학 에서이 반응은 "연관 치환"또는 "교환 메커니즘"이라고도 불렸다. 다음 그림은 s n 의 메커니즘을 보여줍니다 2 반응. 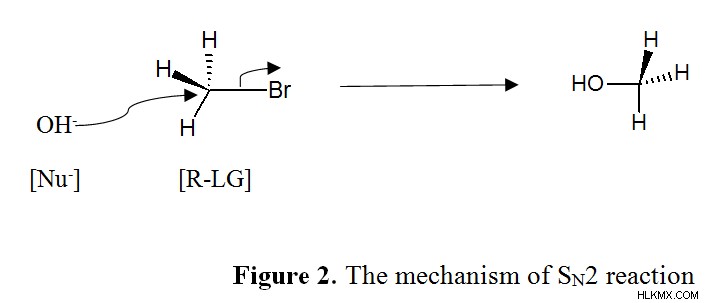
여기서, 친 뉴 클레오 파일은 잎 그룹의 반대 방향을 공격합니다. 따라서 s n 2 반응은 항상 입체 화학의 역전으로 이어진다. 이 반응은 부피가 큰 알킬 그룹이 친핵체의 후면 공격을 차단하기 때문에 메틸 및 1 차 할로드와 가장 잘 작동합니다. 또한, 음이온으로서의 잎 그룹의 안정성과 탄소 원자에 대한 결합의 강도는 모두 반응 속도에 영향을 미칩니다.
다음 그림은 s n 의 에너지 프로파일 다이어그램을 보여줍니다. 1 및 s n 2 반응.
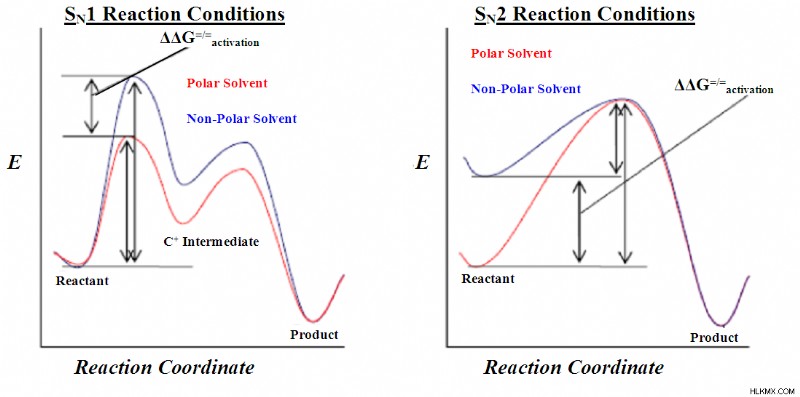
s n 의 차이 1 및 s n 2 반응
법률
s n 1 반응 : s n 1 반응은 단 분자 및 1 차 반응이다. 따라서 기질은 반응 속도에 영향을 미칩니다.
s n 2 반응 : s n 2 반응은 이질성 또는 2 차 반응이다. 따라서 기질과 친핵체는 반응 속도에 영향을 미칩니다.
rate expression
s n 1 반응 : 이것은 속도 =k [r-lg]로 표현됩니다.
s n 2 반응 : 이것은 속도 =k '[r-lg] [nu]로 표시됩니다.
아니요. 반응의 단계
s n 1 반응 : s n1 반응은 단 1 단계 만 있습니다.
s n 2 반응 : s n 2 반응에는 2 단계가 있습니다.
탄수화물 형성
s n 1 반응 : 반응 동안 안정적인 탄수화물이 형성됩니다.
s n 2 반응 : 카보로 위치는 반응 동안 형성되지 않습니다.이 그룹의 분리와 새로운 결합의 형성이 동시에 발생하기 때문입니다.
중간 상태
s n 1 반응 : 이것은 일반적으로 두 개의 중간 상태를 가지고 있습니다.
s n 2 반응 : 이것은 일반적으로 하나의 중간 상태를 가지고 있습니다.
반응의 핵심 요소/ 큰 장벽
s n 1 반응 : 탄수화물 안정성은 반응의 핵심 요소입니다.
s n 2 반응 : 입체 장애는 반응의 핵심 요소입니다.
–r 그룹
에 따른 반응성 순서s n 1 반응 : iii> ii>> i
s n 2 반응 : i> ii>> iii
반응을 진행하기위한 친핵체의 요구 사항
s n 1 반응 : 약하거나 중성 친핵체가 필요합니다.
s n 2 반응 : 강한 친핵체가 필요합니다.
반응 유리한 용매
s n 1 반응 : 알코올과 같은 극성 제자는 유리한 용매입니다.
s n 2 반응 : DMSO 및 아세톤과 같은 극성 aprotic은 유리한 용매입니다.
입체 화학
s n 1 반응 : 입체 화학 유지 또는 역전이 발생할 수 있기 때문에 제품은 인종 혼합물 일 수 있습니다.
s n 2 반응 : 입체 화학의 역전은 항상 발생합니다.