주요 차이 - 양이온 대 음이온
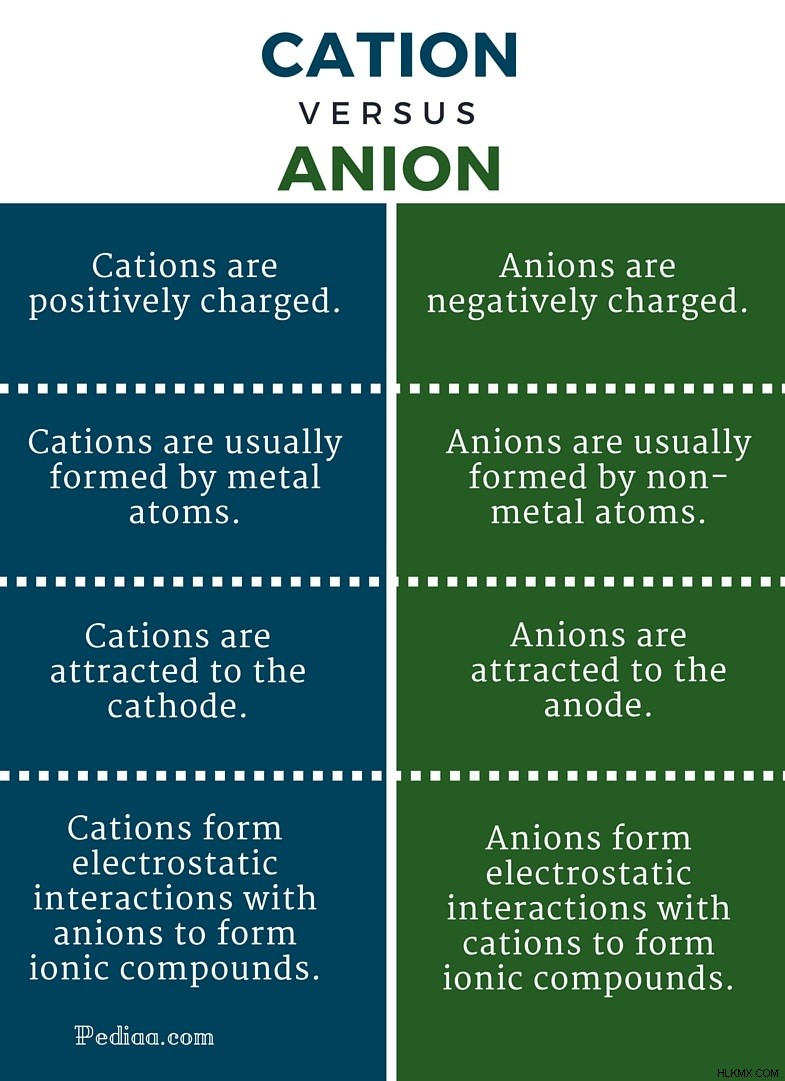
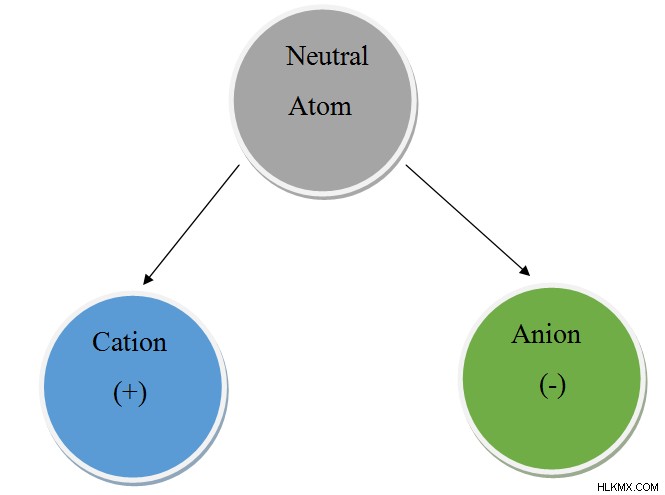
양이온과 음이온은 화학에서 반대 용어이며 형성된 두 가지 주요 유형의 이온을 나타냅니다. 이온은 실제 상태와 비교하여 전자의 손실 또는 이득에 대한 물질 상태입니다. 요소가 원래 형태로 유지되면 '원자'로 알려져 있습니다. 그러나 대부분의 요소는 본질적으로 원자 상태에 남아 있지 않습니다. 그들은 고귀한 가스와 같은 안정성을 얻기 위해 전자를 획득하거나 경품하는 경향이 있습니다. 화합물의 형성을위한 사전 단계로서,이 원자들은 그것들을 '양이온'또는 '음이온'이라는 위치 또는 상태로 변형시킨다. 원자가 전자를 줄 때 양이온이 형성된다. 원자가 전자를 획득 할 때 음이온이 형성됩니다 . 이것이 주요 차이 입니다 양이온과 음이온 사이.
양이온이란 무엇입니까
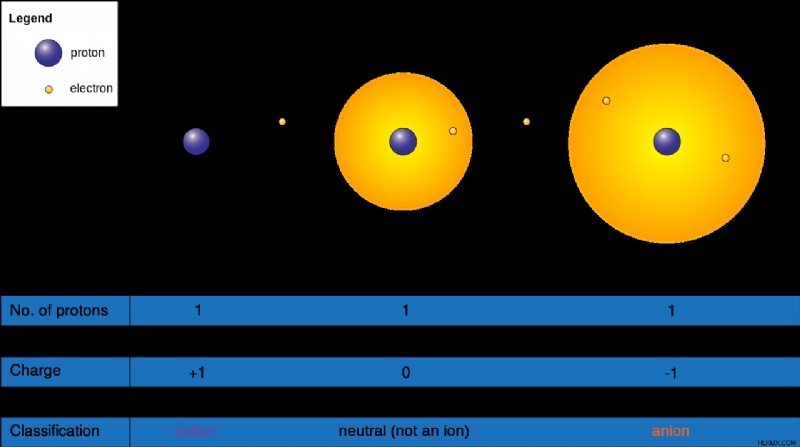
위에서 언급 한 바와 같이, 원자가 전자를 줄 때 양이온이 형성됩니다. 원자 핵은 양으로 하전 된 양성자로 구성됩니다. 원래 형태의 원자는 동일한 수의 전자와 양성자를 가지고 있습니다. 전자는 음으로 하전되며 양성자와 유사한 전하를 갖는다. 따라서, 원자가 전자를 제거 할 때, 핵의 양성자 수가 쉘의 전자 수를 초과함에 따라 상대적 양전하를 발생시킨다. 따라서 양이온이 긍정적으로 하전됩니다.
양이온은 일반적으로 고귀한 가스 구성을 얻기 위해 금속 원자에 의해 형성됩니다. 그리스어로 양이온이라는 단어는 '다운'을 의미하며, 이는 전자 수의 낮추는 것과 관련이있을 수 있습니다. 전기 분해 공정 동안, 캐소드가 음전하를 생성함에 따라 양이온이 캐소드에 끌린다. 양이온은 본질적으로 원소 또는 복잡 할 수 있습니다. 양이온 복합체에는 양전하를 공유하는 여러 요소가 함께 그룹화 될 것입니다. 이것은 d 블록 요소들 사이에서 일반적입니다. 또한, 단일 원소는 산화 상태에 따라 여러 양이온을 가질 수 있습니다. 즉, 단수 전하, 이중 충전, 트리비 충전 등 일부 공통 양이온 포함하다; NA, CA, FE 등.
음이온이란 무엇입니까
소개에서 언급했듯이, 원자가 전자를 획득 할 때 음이온이 형성됩니다. 따라서, 이들 전자의 첨가로 인해, 원소 쉘 내의 전자의 수는 핵 내의 양성자 수를 초과한다. 양성자가 양으로 하전되고 전자가 음으로 하전되면 음이온은 음전하를 발생시킵니다.
음이온은 일반적으로 고귀한 가스 구성을 얻기 위해 비금속 요소에 의해 형성됩니다. 그리스어의 음이온이라는 단어는 'UP'을 의미하며, 이는 요소 내의 전자 수의 증가와 관련이있을 수 있습니다. 전기 분해 과정에서, 양극이 양전하를 생성하므로 음이온이 양극에 끌린다. 음이온은 본질적으로 원소 또는 복잡 할 수 있습니다. 음이온 복합체에는 음전하를 공유하는 여러 요소가 함께 그룹화 될 것입니다. 이것은 d 블록 요소들 사이에서 일반적입니다. 또한, 단일 원소는 산화 상태에 따라 여러 음이온을 가질 수있다. 즉, 단수 전하, 이중 충전, 트리 충전 등. 일부 공통 양이온은 포함됩니다. f, o, no 3 기타.
정의
a 양이온 안정성을 높이기 위해 쉘에서 하나 이상의 전자가 방출되어 긍정적으로 하전 된 이온입니다.
음이온 안정성을 높이기 위해 하나 이상의 전자를 쉘에 수용함으로써 부정적인 하전 된 이온입니다.
충전
양이온 긍정적으로 부과됩니다.
음이온 부정적인 부전.
원자 형태
양이온 일반적으로 금속 원자에 의해 형성됩니다.
음이온 일반적으로 비금속 원자에 의해 형성됩니다.
전기 분해
양이온 음극에 끌립니다 (음전하를 생성하는 끝).
음이온 양극에 끌립니다 (긍정적 인 전하를 일으키는 끝).
화합물 형성
양이온 음이온과의 정전기 상호 작용을 형성하여 이온 성 화합물을 형성합니다.
음이온 양이온과의 정전기 상호 작용을 형성하여 이온 성 화합물을 형성합니다.