주요 차이 -아질산염 대 아질산염
질산염과 아질산염은 무기 화학 화합물이며, 이름이 암시 한 바와 같이, 그 특징적인 요소는 'n'또는 질소이며, 원자가는 7입니다. 질소는 자연의 무취-이형 가스이며 반응성입니다. 요소 질소는 또한 전기 음성이 높다. 질산염과 아질산염은 두 가지 중요한 부류의 질소 함유 화합물입니다. 주요 차이 질산염과 아질산염 사이에는 질산염 그룹이 하나의 질소 원자와 3 개의 산소 원자가 포함되어 있다는 것입니다. 아질산염 그룹에는 하나의 질소 원자와 2 개의 산소 원자가 포함되어 있습니다 .
질산염이란 무엇입니까
질산염은 질소와 산소 원자로 만들어진 다 원자 이온입니다. 화학 구조는 하나의 질소 원자와 3 개의 산소 원자를 함유하며 분자식 NO3-로 표시됩니다. 질산염 그룹은 무기 화학에서 기능적 그룹으로 설명 될 수있다. 화합물은 삼각 평면 형상을 갖는다. 이것은 화합물 내의 원자가 3 차원 공간에서 어떻게 배열되는지 알려줍니다. 질산염의 구조에 따르면, 질소는 중심이며 3 개의 동일한 산소 원자에 결합됩니다. 그러나, 일정 시간에, 하나의 산소 원자만이 질소 중심에 이중 결합되고, 다른 2 개의 산소 원자는 단일 결합을 통해 결합된다. 그러나, 3 개의 산소 원자가 서로 동일하기 때문에, 구조는 화학의 공명 원리에 따른 것으로 여겨진다. 따라서, 이중 결합은 산소 원자와 질소 중심 사이에서 이동할 수 있음을 시사한다. 또한 질소는 질산염에서 +5의 산화 수가 있습니다.
질산 이온은 -1의 전체 전하를 가지지 만, 이온 내의 전하 분포를 고려할 때, 질소 원자는 +1의 전하를 전달하고, 각 산소 원자는 -(2/3)의 전하를 전달합니다. 일반적으로 모든 질산염 염은 물에 용해됩니다. 물을 사용하면 질산염 이온은 질산을 형성하여 강산으로 간주됩니다. 질산염 화합물은 농업의 비료, 폭발물 및 총 가루 등의 생산에 사용됩니다. 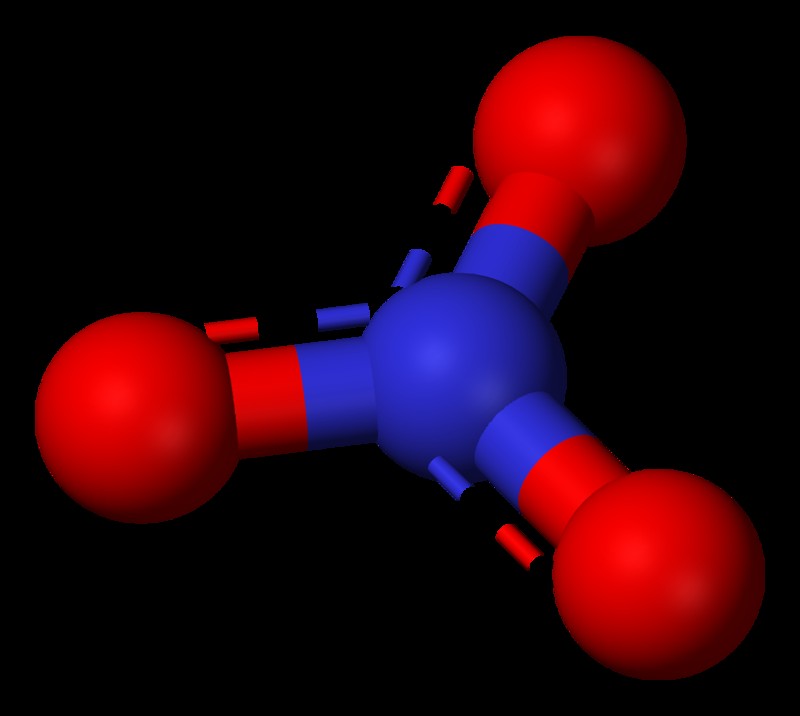
아질산염
아질산염은 또한 N 및 O 원자를 함유하는 다 원자 이온이며, 여기서 질소의 산화 수는 +3입니다. 아질산염 그룹은 하나의 질소 원자와 2 개의 산소 원자를 함유하며 분자식 인 NO2-로 표시됩니다. O-N-O 결합 각도는 대략 120 °입니다. 이것은 우리에게 원자가 3 차원 공간에서 어떻게 배열되는지 아이디어를 제공합니다. 아질산염 이온은 질산염의 질소의 산화 수가 질산염보다 작기 때문에 질산염을 형성하기 위해 산화 될 수 있습니다.
물과 반응하면 아질산염은 아질산을 형성하며, 이는 무기 화학에서 약산으로 간주됩니다. 아질산염 화합물의 화학 구조에서, 하나의 산소 원자는 질소 중심에 이중으로 결합되고, 다른 산소는 단독으로 결합된다. 그러나, 공명 원리가 그룹의 구조 관계를 지배함에 따라, 산소 원자와 질소 원자 사이의 이중 결합은 지속적으로 이동하는 것으로 간주된다; 따라서, 두 산소 원자는 동일한 상태를 가질 것이다. 아질산염은 질산화 박테리아에 의해 생산되며 종종 식품 산업에서 고기 치료를 위해 사용됩니다. 또한 산화 질소의 혈관 확장제라는 중요한 생화학 적 역할이 있습니다. 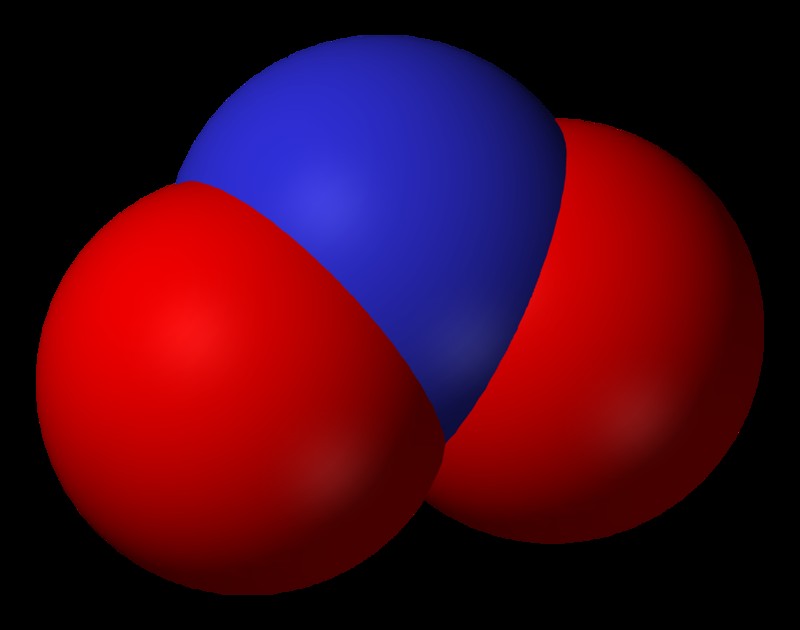
질산염과 아질산염의 차이
정의
질산염 하나의 질소 원자와 3 개의 산소 원자로 만들어진 -1의 전하를 보유하는 무기 다 원자 이온입니다.
.아질산염 하나의 질소 원자와 2 개의 산소 원자로 만들어진 -1의 전하를 보유하는 무기 폴리 원자 이온입니다.
.산화 번호
질산 질소에서 질소의 산화 수 +5입니다.
아질산염 의 질소의 산화 수 +3입니다.
분자 모양
질산염 삼각 평면 형상이 있습니다.
아질산염 구부러진 분자 형상이 있습니다.
물과의 반응
질산염 강산 인 질산을 형성합니다.
아질산염 약산 인 아질산을 형성합니다.
산화 및 환원
질산염 아질산염을 형성하기 위해 축소 될 수 있습니다.
아질산염 질산염을 형성하기 위해 산화 될 수 있습니다. 
이미지 제공 :
Benjah-BMM27의“질산염 -3D 볼”-자신의 작업. (공개 도메인) 커먼즈를 통한
“아질산염 -3D-VDW”. (공개 도메인) 커먼즈를 통한