주요 차이 - 분자간 대 분자 내 수소 결합
분자는 동일한 요소 또는 다른 요소의 원자가 모여 전자를 공유하고 공유 결합을 만들 때 형성됩니다. 공유 분자를 함께 유지하는 두 가지 유형의 매력적인 힘이 있습니다. 이것을 분자간 힘과 분자 내 힘이라고합니다. 분자간 힘은 두 분자 사이에서 발생하는 매력 인 반면 분자 내 힘은 분자 자체 내에서 발생합니다. 수소 결합은 고도로 전기 음성 원자를 갖는 수소 원자 공유 전자에 의해 제조 된 분자로 형성되는 특수 유형의 결합이다. 수소 결합은 분자간 및 분자 내 힘으로 발생할 수 있습니다. 분자간과 분자 내 수소 결합의 주요 차이점은 분자간 결합이 두 이웃 분자 사이에서 발생하는 반면 분자 내 수소 결합은 분자 자체 내에서 발생한다는 것입니다.
분자 나 공유 화합물을 함께 유지하는 방법을 이해하기 위해이 두 힘의 기능을 개별적으로 아는 것이 중요합니다.
이 기사는
에 대해 설명합니다 1. 수소 결합이란 무엇입니까?
2. 분자간 수소 결합이란 무엇입니까?
- 정의, 특징 및 속성, 예
3. 분자 내 수소 결합이란 무엇입니까?
- 정의, 특징 및 속성, 예
4. 분자간과 분자 내 수소 결합의 차이점은 무엇입니까? 
수소 결합이란 무엇입니까
중간 정도의 전기 음성 인 수소가 강하게 전기 음성 원자에 공유 결합 될 때, 그들이 공유하는 전자 쌍은 고도로 전기성 원자에 더 편향됩니다. 이러한 원자의 예는 N, O 및 F이다. 수소 결합이 형성 될 수소 수용체 및 수소 공여체가 있어야한다. 수소 공여체는 분자에서 고도로 전기 음성 원자이며 수소 수용체는 이웃 분자에서 고도로 전기 음성 수소 원자이며 고독한 전자 쌍을 가야합니다.
.수소 결합은 두 분자 사이 또는 분자 내에서 나타날 수 있습니다. 이 두 유형은 분자간 수소 결합 및 분자 내 수소 결합으로 알려져 있습니다.
분자간 수소 결합이란 무엇입니까
분자간 수소 결합은 분자와 비슷하거나 분자 사이에서 발생할 수 있습니다. 수용자 원자의 위치는 기증자와 상호 작용할 수 있도록 적절하게 배향되어야합니다.
시나리오를 명확하게 이해하기 위해 물 분자를 살펴 보겠습니다.
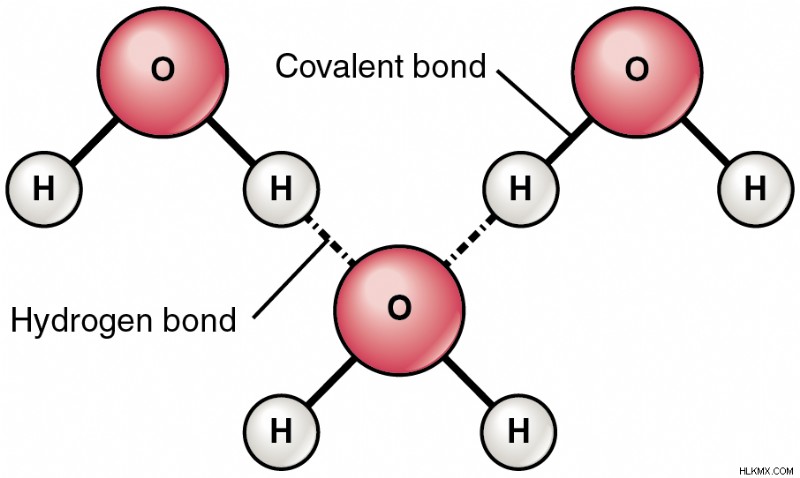
그림 1 :물 분자에서의 수소 결합
H와 O 원자 사이에 공유되는 전자 쌍은 산소 원자에 더 끌립니다. 따라서, O 원자는 H 원자에 비해 약간의 음전하를 얻는다. O 원자는 Δ-로 표시되고 H 원자는 Δ+로 표시됩니다. 두 번째 물 분자가 전자 근처에 오면, 다른 물 분자의 Δ- O 원자 사이에 정전기 결합이 형성된다. 분자의 산소 원자는 공여자 (b) 및 수용체 (a)로서 행동한다.
물은 수소 결합으로 인한 매우 특별한 특성을 가지고 있습니다. 그것은 좋은 용매이며 높은 끓는점과 높은 표면 장력을 가지고 있습니다. 또한, 4 ℃에서의 얼음은 물보다 밀도가 낮다. 따라서 얼음은 겨울 동안 수생 생물을 보호하는 액체 물에 떠 다니고 있습니다. 물의 이러한 특징으로 인해 Universal Solvent라고 불리며 지구상의 생명을 유지하는 데 중요한 역할을합니다.
분자 내 수소 결합이란 무엇입니까
수소 결합이 동일한 분자의 두 기능 그룹 내에서 발생하면 분자 내 수소 결합이라고합니다. 이것은 수소 공여체와 수용체가 둘 다 같은 분자 내에있을 때 발생합니다.

그림 2 :분자 내 수소 결합을 갖는 O- 니트로 페놀 (Ortho-Nitrophenol)의 구조
o- 니트로 페놀 분자에서 –oh 그룹의 O 원자는 h보다 전기 음성이므로 Δ-. 반면에 H 원자는 Δ+입니다. 따라서, –oh 그룹의 O 원자는 H 공여체 역할을하는 반면, 니트로 그룹의 O 원자는 H- 수용체 역할을한다.
.분자간과 분자 내 수소 결합의 차이
결합 형성
분자 수소 결합 : 분자간 수소 결합은 두 이웃 분자 사이에서 발생합니다.
분자 내 수소 결합 : 분자 내 수소 결합은 분자 자체 내에서 발생합니다.
물리적 특성
분자 수소 결합 : 분자간 수소 결합은 높은 용융 및 끓는점 및 낮은 증기압을 갖는다.
분자 내 수소 결합 : 분자 내 수소 결합은 녹는 점과 비등점이 낮고 증기압이 높습니다.
안정성
분자간 수소 결합 : 안정성은 비교적 높습니다.
분자 내 수소 결합 : 안정성은 비교적 낮습니다.
예제
분자 수소 결합 : 물, 메틸 알코올, 에틸 알코올 및 당은 분자간 수소 결합의 예입니다.
분자 내 수소 결합 : O- 니트로 페놀 및 살리실산은 분자 내 수소 결합의 예이다.
요약 - 분자간 대 분자 내 수소 결합
분자간 수소 결합을 갖는 화합물은 분자 내 수소 결합을 갖는 화합물보다 더 안정적입니다. 분자간 수소 결합은 하나의 분자를 다른 분자와 연결하여 함께 결합시킬 책임이 있습니다. 이와 반대로, 분자 내 수소 결합이 발생할 때, 분자는 서로 상호 작용할 수 없으며 분자는 함께 붙어있는 경향이 적다. 이로 인해 끓는점과 융점이 감소합니다. 또한, 분자 내 수소 결합을 갖는 분자는 더 휘발성이며 비교적 증기압이 더 높다.
분자간 수소 결합을 가진 화합물은 유사한 성질의 화합물에 쉽게 용해되는 반면, 분자 내 수소 결합을 가진 화합물은 쉽게 용해되지 않습니다.
"수소 결합." 화학 libretexts . LibreTexts, 2016 년 7 월 21 일. 웹. 2017 년 2 월 7 일.
"수소 결합 :수용자 및 기증자." 위스콘신 대학교, N.D. 편물. 2017 년 2 월 7 일.
"알코올, 카르 복실 산 및 기타 분자 및 그 중요성에서 간 및 분자 내 수소 결합." 유기 화학 . N.P., 10 월 2012. 웹. 07 년 2 월. 2017.
"분자 내 대 분자간 수소 결합의 강도." 화학 스택 교환 . N.P., 2013. 웹. 2017 년 2 월 7 일.
이미지 제공 :
“O-Nitrophenol wasserstoffbrücke”-Commons Wikimedia를 통해 자신의 작업 (공개 도메인)
“OpenStax College의 물 분자 -01 사이의 210 수소 결합-해부학 및 생리학, Connexions 웹 사이트. Commons Wikimedia를 통해 (CC x 3.0)