주요 차이 - 하이퍼 콘월 vs 공명
공유 화합물에서, 두 가지 주요 유형의 화학적 결합이 원자들 사이에서 관찰 될 수 있습니다. 그들은 시그마 본드와 Pi Bond입니다. 단일 채권은 항상 시그마 채권입니다. 이중 채권은 시그마 본드와 PI 결합으로 구성됩니다. 그러나, 두 유형의 결합은 원자 궤도 사이의 중첩으로 인해 형성된다. 하이퍼 콘분 및 공명이라는 용어는 분자 안정화에 관여하는 두 가지 방법을 설명하는 데 사용됩니다. 과다 조합과 공명의 주요 차이점은 과잉 조합은 시그마 본드와 P 궤도 또는 PI 결합 사이의 상호 작용을 포함하는 반면 공명은 PI 결합 사이의 상호 작용을 포함한다는 것입니다.
주요 영역을 다루었습니다
1. 하이퍼 콘월 링은 무엇입니까
- 정의, 메커니즘 및 예
2. 공명이란?
- 정의, 메커니즘 및 예
3. 과도한 공명과 공명의 차이점은 무엇입니까
- 주요 차이점 비교
핵심 용어 :원자 궤도, 하이퍼 콘디션, PI 본드, 공명, 시그마 본드

hyperconjugation
HyperConjugation은 시그마 결합과 PI 결합 사이의 상호 작용으로 인해 분자에 대한 안정화 효과입니다. 여기서, 시그마 궤도는 인접한 빈 p 궤도, 부분적으로 채워진 p 궤도 또는 pi 궤도와 상호 작용합니다. 이 상호 작용은 이러한 궤도의 겹치는 것입니다. 이것은 결합 전자에 더 많은 공간을 제공하는 연장 된 분자 궤도의 형성을 초래한다. 그런 다음 전자 사이의 반발력이 감소합니다. 결과적으로 분자는 안정화됩니다. 일반적으로, 과잉 조합은 인접한 탄소의 2p 또는 Pi 궤도를 갖는 C-H 시그마 결합의 결합 전자의 겹치는 것을 통해 발생한다.
.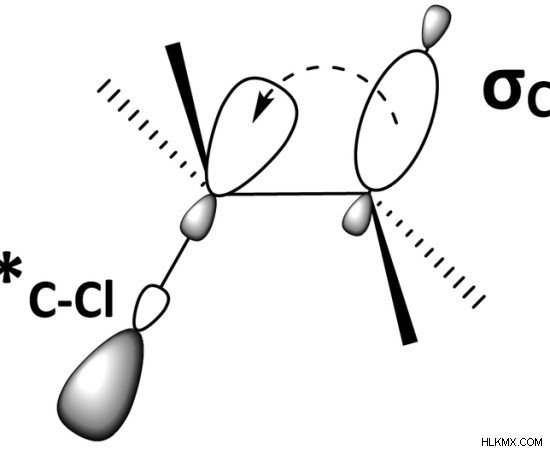
그림 1 :안티 본딩 궤도 (C-Cl)와 결합 궤도 (C-H)의 중첩
hyperconjugation은 화학 결합의 결합 길이에 영향을 미칩니다. 일반적으로, 두 원자 사이의 시그마 결합은 동일한 두 원자 사이의 PI 결합보다 길다. 과잉 조합은 시그마 결합의 길이가 감소되고 PI 결합의 길이가 증가하게됩니다. 또한 탄수화물의 안정성을 높이는 데 도움이됩니다.
공명이란?
공명은 pi orbital에서 결합 전자의 비편성을 통한 분자의 안정화입니다. 전자는 원자 나 분자에 고정 된 위치가 없기 때문에 여기저기서 쉽게 움직일 수 있습니다. 따라서, 안정화 상태를 얻기 위해 고독한 전자 및 PI 결합 전자는 한 위치에서 다른 위치로 이동할 수있다. 이것을 공명이라고합니다. 가장 안정적인 형태의 분자를 결정하기 위해, 우리는 특정 분자가 가질 수있는 모든 가능한 구조를 나타내는 공명 구조를 사용합니다.
.공명 구조는 같은 수의 전자와 동일한 분자식을 갖습니다. 분자에서 원자의 혼성화는 동일한 수의 고독한 쌍과 함께 모든 공명 구조에서 동일해야합니다.
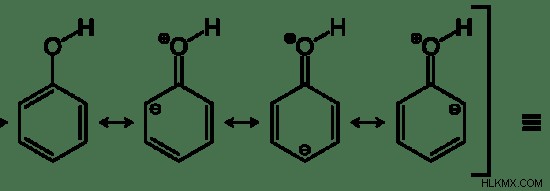
그림 2 :페놀의 공명 구조
위의 이미지는 페놀의 가능한 모든 공명 구조를 보여줍니다. 공명 구조의 끝에서, 페놀 분자의 원래 구조가 제공되었다. 그것은 실제 분자에 순수한 이중 결합이 없음을 나타냅니다. 3 개의 이중 결합 대신 PI 전자 구름이 있습니다. 따라서 공명은 공명 구조에 중간 구조를 제공합니다.
과잉 조합과 공명의 차이
정의
hyperconjugation : 과잉 조합은 시그마 결합과 PI 결합 사이의 상호 작용으로 인한 분자에 대한 안정화 효과입니다.
.공명 : 공명은 PI 궤도에서 결합 전자의 비편성을 통한 분자의 안정화입니다.
궤도 관련
하이퍼 컨쥬 게이션 : 과잉 조합은 시그마 본드 궤도 및 P 궤도 또는 PI 본드 궤도를 포함합니다.
공명 : 공명은 pi 결합 궤도 만 포함됩니다.
본드 길이
하이퍼 컨쥬 게이션 : 과잉 콘착으로 시그마 본드 길이가 단축됩니다.
공명 : 공명은 시그마 본즈에 영향을 미치지 않습니다.
결론
HyperConjugation은 두 방법 모두 전자의 비편 재화를 통해 분자의 안정화를 유발하기 때문에 공명의 확장입니다. 그러나, 과도 조합은 PI 결합 전자와 함께 시그마 결합 전자의 비편 재화를 포함하는 반면, 공명은 PI 궤도 사이의 상호 작용을 통해 비편성을 유발한다. 이것은 하이퍼 콘월 테이션과 공명의 차이입니다.