주요 차이 - 단일 변형 대이 바이 바스 대 트리 바스 산
산은 산성 특성을 가진 화합물입니다. 산은 또한 소금과 물을 형성하는 염기와 반응 할 수있는 화학 종으로 정의 될 수있다. 강산과 약산과 같은 두 가지 주요 유형이 있습니다. 산은 또한 모노바스산, 디바 산 및 트라이 바스 산으로 세 가지 그룹으로 분류 될 수 있습니다. 산은베이스와 반응하기 위해 가지고있는 양성자의 수에 따라 이러한 방식으로 그룹화된다. Dibasic 및 Tribasic Acid를 함께 폴리베이스 산이라고합니다. 이들 모노바스 및 폴리 - 기생산은 강산 또는 약산 일 수있다. 모노 바스 성 이질과 트라이 바스 산의 주요 차이점은 모노바스 산은 하나의 교체 가능한 수소 원자 만 있고 디바 산은 2 개의 교체 가능한 수소 원자를 갖는 반면, 트리 바스 산은 3 개의 교체 가능한 수소 원자를 갖는다는 것입니다. .
주요 영역을 다루었습니다
1. 모노바스산
- 정의, 해리 및 예
2. dibasic acids
- 정의, 해리 및 예
3. 트리 바스 산
- 정의, 해리 및 예
4. 일체 성 이질과 트라이 바스 산의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :산, 디바 산, 모노바스 산, 염, 트라이 바스 산

모노바스 산
사라산은 하나의 산 분자 당 하나의 교체 가능한 수소 원자를 갖는 산성 화합물입니다. 수용액에서, 이들 산은 하나의 양성자 (수소 원자)를 제거 할 수있다. 따라서이를 모노 프 로스 산 이라고합니다 . 모노바스 산은 모노바스 산과 염기 사이의 반응을 위해 하나의 수소 원자를 기증 할 수 있습니다.
모노바스산의 해리는 시스템에 하나의 수소 원자를 기증하기 때문에, 모노바스산의 해리 상수에 대한 방정식은 단 하나의 H 이온의 농도를 포함한다. 모노바스 산의 해리는 다음과 같이 표시 될 수 있습니다.
ha (aq) → h (aq) +a (aq)
또는
ha (aq) +h 2 o (l) → a (aq) +h 3 o (aq)
해리 상수 ka =[h (aq) ] [a (aq) ] / [ha (aq) ]] 
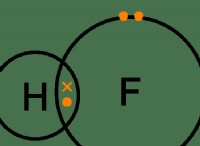
그림 1 :염산 구조 (수소 원자는 빨간색으로 표시됨)
유기 및 무기 모노바스산이 있습니다. 일부는 강산 인 반면 다른 일부는 약산입니다. HCL, HNO 3 와 같은 강한 모노바스 산 , HBR은 하나의 수소를 기초에 완전히 분리하고 기증 할 수 있습니다. 아세트산과 같은 약한 모노바스산 (CH <서브> 3 COOH)는 부분적으로 분리된다.
dibasic acids
dibasic acid는 산 분자 당 대체 가능한 수소 원자가있는 화합물입니다. 따라서, 이들 디바 산은 디바 산과 염기 사이의 반응을 위해 2 개의 수소 원자를 기증 할 수있다. 수용액에서, 디바 산은 시스템에 2 개의 수소 이온 (H)을 제공하는 분리를 해산시킨다. 따라서 이것들을 디프로 산 이라고도합니다 .
dibasic acid의 해리는 다음과 같이 제공 될 수 있습니다. Dibasic acid는 두 개의 해리 상수 값을 갖는다. 이들은 첫 번째 해리와 두 번째 해리를위한 것입니다.
H 2 b (aq) → 2h (aq) +b (aq)
또는
H 2 b (aq) → h (aq) +hb (aq) ; ka1
hb (aq) → h (aq) +b (aq) ; ka2
해리 상수 ka1 =[h (aq) ] [hb (aq) ] /[h 2 b (aq) ]]
해리 상수 ka2 =[h (aq) ] [b (aq) ] /[hb (aq) ]] 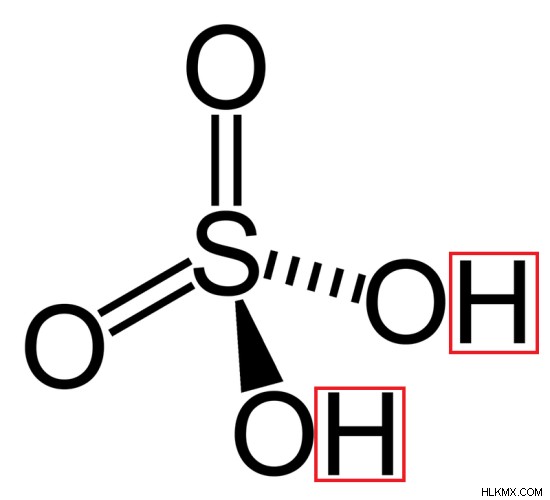
그림 2 :황산의 구조 (2 개의 수소 원자가 적색으로 표시됨)
dibasic acid는 강한 dibasic acid와 약한 dibasic acid로 두 가지 유형으로 발견 될 수 있습니다. 강한 디바 산은 2 개의 수소 원자와 산의 공액 이온에 완전히 분리된다. 그들의 첫 번째 이온화는 강합니다. 그러나 약한 디바 산은 부분적으로 2 개의 수소 원자와 산의 공액 이온으로 분리된다. Dibasic Acid의 몇 가지 일반적인 예에는 H 2 가 포함됩니다 그래서
Tribasic acids
tribasic acid는 3 개의 대체 가능한 수소 원자가있는 화학 화합물입니다. 이 산은 트리바 산과 염기 사이의 반응을 위해 3 개의 수소 이온을 기증 할 수 있습니다. 그것들은 3 개의 H 이온 (양성자)을 제거 할 수 있기 때문에,이 산은 트리 프로산 라고도합니다. .
트리바 산의 해리는 시스템에 세 가지 수소 이온을 제공합니다. 따라서, 트리 바스 산의 해리는 3 개의 해리 상수를 갖는다.
H 3 c (aq) → 3H (aq) +c (aq)
또는
H 3 c (aq) → h (aq) + h 2 c (aq) ; ka1
H 2 c (aq) → h (aq) +hc (aq) ; ka2
hc (aq) → h (aq) +c (aq) ; ka3
해리 상수, ka1 =[h (aq) ] [h 2 c (aq) ] /[h 3 c (aq) ]]
해리 상수, ka2 =[h (aq) ] [hc (aq) ] /[h 2 c (aq) ]]
해리 상수, ka3 =[h (aq) ] [c (aq) ] /[hc (aq) ]] 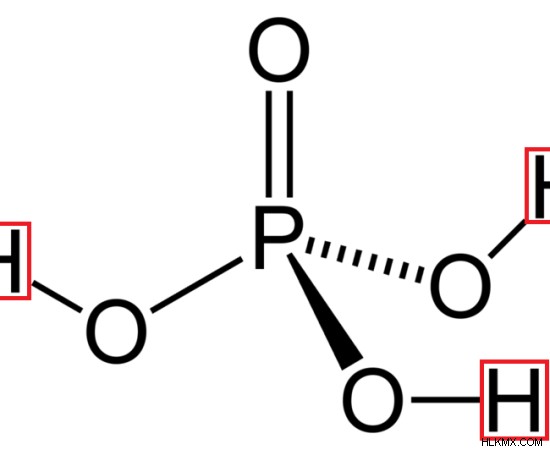
그림 3 :인산의 구조 (3 개의 수소 원자가 적색으로 표시됨)
일반적인 무기 트리바 산은 인산 (H 3 po 4 ). 그것은 인 원자 주위에 3 개의 산소 원자에 결합 된 3 개의 수소 원자로 구성됩니다. 이들 수소 원자는 분자에서 대체되거나 제거 될 수있다. 일반적인 유기 트리바 산은 구연산입니다.
단일 변형 이질과 트라이 바스 산의 차이
정의
모노바스 산 : 모노바스 산은 산 분자 당 하나의 대체 가능한 수소 원자를 갖는 산성 화합물이다.
dibasic acid : 디바 산은 산 분자 당 2 개의 대체 가능한 수소 원자를 갖는 화학 화합물입니다.
tribasic acid : Tribasic acid는 산 분자 당 3 개의 교체 가능한 수소 원자를 갖는 화학 화합물입니다.
산-염기 반응에 대해 기증 된 수소 이온
모노바스 산 : 모노바스 산은 산-염기 반응을 위해 하나의 수소 이온 만 기증 할 수 있습니다.
Dibasic Acid : 디바 산은 산-염기 반응을 위해 2 개의 수소 이온을 기증 할 수 있습니다.
tribasic acid : 트라이 바스 산은 산-염기 반응을 위해 3 개의 수소 이온을 기증 할 수 있습니다.
해리
모노바스 산 : 모노바스산은 단계적 분리가 없다.
Dibasic Acid : 디바 산은 두 단계로 분리됩니다.
tribasic acid : 트리 바스 산은 세 단계로 분리됩니다.
해리 상수
모노바스 산 : 모노바스산은 하나의 해리 상수 만 있습니다.
Dibasic Acid : 디바 산은 2 개의 해리 상수를 갖는다.
tribasic acid : 트리 바스 산에는 3 개의 해리 상수가 있습니다.
결론
산은 시스템에 양성자 (또는 H 이온)를 방출 할 수있는 화합물입니다. 따라서, 산의 존재는 해당 시스템의 낮은 pH 값으로 표시된다. 시스템의 산도는 해당 시스템에 존재하는 산의 유형에 의존합니다. 산은 주로 강산 및 약산으로 분류됩니다. 이들 산이 산-염기 반응을 위해 기증하는 양성자의 수에 따르면, 산은 또한 모노바스산 및 폴리 기생산으로 그룹화 될 수있다. 디바 산과 트라이 바스 산은 폴리 바스 산이다. 모노 바스 성 이질과 트라이 바스 산의 주요 차이점은 모노 바스 산이 하나의 대체 수소 원자를 갖고 디바 산은 2 개의 교체 가능한 수소를 갖는 반면, 트리 바스 산은 3 개의 대체 수소 원자를 갖는다는 것이다.
.