주요 차이 - 연소 대 열분해
연소 및 열분해는 열 화학적 반응입니다. 연소는 발열 화학 반응이다. 연료의 연소는 에너지의 형태로 빛과 열을 형성 할 수 있습니다. 열분해는 분해 반응이다; 여기서, 유기 물질은 열이 제공 될 때 분해됩니다. 이 두 과정 모두 열 화학적 반응이지만 두 과정간에 차이가 있습니다. 연소와 열분해의 주요 차이점은 연소가 산소의 존재하에 수행되는 반면, 열분해는 산소의 부재 (또는 거의 부재) 입니다.
주요 영역을 다루었습니다
1. 연소 란?
- 정의, 완전하고 불완전한 연소, 사용
2. 열분해 란 무엇입니까
- 정의, 프로세스 및 사용
3. 연소와 열분해의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :연소, 연소, 완전한 연소, 분해, 발열 반응, 불완전한 연소, 열분해, 열 화학적 반응

연소가 무엇인지
연소는 물질과 산소 사이의 반응을 포함하여 에너지의 형태로 빛과 열을 생성하는 화학 반응입니다. 이 과정을 Burning이라고도합니다. 열과 빛은 반응의 결과로 주어진 에너지 형태입니다. 빛 에너지는 불꽃으로 나타납니다. 그러나 대부분의 에너지는 열 에너지로 방출됩니다.
연소 반응은 완전한 연소 및 불완전한 연소로 두 가지 유형으로 발견 될 수 있습니다.
완전 연소
완전한 연소는 반응을 위해 과도한 산소가 존재할 때 발생합니다. 이것은 제한된 수의 제품을 제공합니다. 연료가 연소되면 이산화탄소와 물을 최종 제품으로 제공합니다. 요소가 불에 타면 그 요소의 가장 안정적인 산화물을 제공합니다.
불완전한 연소
불완전한 연소는 적은 양의 산소가있을 때 발생합니다. 이것은 결국 더 많은 제품을 제공합니다. 연료가 불완전한 연소를 받으면 이산화탄소 및 물과 함께 일산화탄소를 제공합니다. 때로는 번지지 않은 탄소 요소조차도 생성됩니다. 여기에서 탄소는 그을음으로 방출됩니다.

그림 1 :화재는 연소의 결과 입니다
연소 반응의 많은 용도가 있습니다. 한 가지 주요 용도는 연료를 태워 에너지 생산입니다. 이것은 산업, 자동차 등에서 중요합니다. 화재를 일으키는 것은 또 다른 용도입니다. 화재는 요리와 같은 많은 요구에 사용됩니다. 때로는 요소의 연소가 요소를 식별하는 데 사용됩니다. 다른 요소는 연소 될 때 다른 색의 불꽃을줍니다. 이 불꽃을 관찰함으로써 우리는 다른 요소를 식별 할 수 있습니다.
vyrolysis
pyrolysis는 산소가 없을 때 유기 물질의 화학적 분해입니다. 이 과정에는 열을 적용해야합니다. 따라서 온도를 증가시켜 열분해 속도를 증가시킬 수 있습니다.
pyrolysis는 일반적으로 430c 이상의 온도에서 발생합니다. 그러나, 열분해에 대한 산소가없는 대기를 얻는 것은 매우 어렵 기 때문에, 산소가 거의없는 조건 하에서 수행된다. 열분해는 기체 상, 액체 상 및 고체 상으로 최종 생성물을 제공합니다. 대부분의 물질은 가스로 전환됩니다. 때로는 약간의 액체가 형성됩니다. 이 액체를 타르라고합니다. 고체 잔류 물은 전형적으로 숯과 바이오 숯을 포함한다.
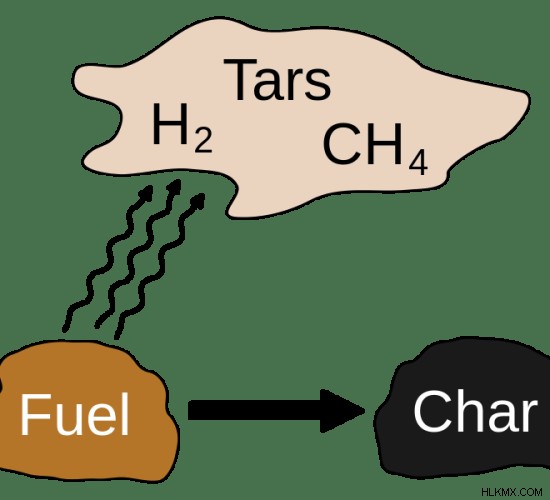
그림 2 :열분해 제품
열분해의 과정은 유기 물질을 기체 성분, 탄소와 재의 고체 잔류 물 및 열매 오일이라고 불리는 액체로 변환합니다. 열분해에는 물질에서 오염 물질을 제거하는 데 사용되는 두 가지 방법이 있습니다. 그들은 파괴와 제거입니다. 파괴에서 오염 물질은 더 작은 화합물로 분해됩니다. 그러나 제거 과정에서 화합물을 파괴하기보다는 오염 물질이 분리됩니다.
pyrolysis는 숯, 활성탄, 메탄올 등의 생산에 유용합니다. 그 외에도, pyrolysis는 토양의 반 볼라티질 유기 화합물, 연료 및 살충제를 치료하고 파괴합니다. 이 과정은 또한 공장에서 나오는 유기 폐기물을 치료하는 데 사용될 수 있습니다.
연소와 열분해의 차이
정의
연소 : 연소는 에너지의 형태로서 빛과 열을 생성하는 물질과 산소 사이의 반응을 포함하는 화학 반응입니다.
열분해 : 열분해는 산소가 없을 때 유기 물질의 화학적 분해입니다.
대기
연소 : 연소는 대기 중에 산소의 존재하에 이루어집니다.
열분해 : 열분해는 산소가 없을 때 수행됩니다.
최종 제품
연소 : 연소는 기체 최종 제품을 생성합니다.
열분해 : 열분해는 미량의 액체 및 고체 잔류 물과 함께 기체 성분을 생성합니다.
유형
연소 : 연소는 완전한 연소 또는 불완전한 연소로 발생할 수 있습니다.
열분해 : 열분해는 진공 상태 또는 산소가 거의없는 대기에서 수행 될 수 있습니다.
결론
연소 및 열분해는 열 화학적 반응입니다. 이러한 반응은 산업 및 일상 요구에 사용됩니다. 이러한 프로세스는 여러 요인에서 서로 다릅니다. 그러나 연소와 열분해의 주요 차이점은 연소가 산소의 존재하에 수행되는 반면, 열분해는 산소의 부재 (또는 거의 부재하에) 수행된다는 것입니다.