주요 차이 - 질소 대 질산염
질소는 주기율표의 그룹 15의 화학 요소입니다. 그것은 수소, 산소, 탄소 등과 같은 다른 다른 원소와 결합하여 다른 유형의 분자와 이온을 형성 할 수 있습니다. 질산염은 질소 원자가 음이온을 형성하는 3 개의 산소 원자에 결합하는 이온 중 하나입니다. 질산염 이온은 질산의 에스테르와 같은 상이한 양이온 및 공유 화합물과 조합하여 상이한 염 화합물을 형성 할 수있다. 질소와 질산염의 주요 차이점은 질소는 화학 요소이고 질산염은 음이온이라는 것입니다.
주요 영역을 다루었습니다
1. 질소
- 정의, 화학적 특성
2. 질산염이란?
- 정의, 질산염의 화합물
3. 질소와 질산염의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :아미드, 암민, 음이온, 양이온, 공유, 질산염, 질소, 질소주기, 산소, 상대 원자 질량, 공명

질소
질소는 주기율표의 그룹 15의 화학 요소이며 화학 기호 "N"이 있습니다. 질소는 전자 구성에 따른 P 블록 요소이며; [그는] 2S2P . 원자의 질소는 7이고 상대 원자 질량은 약 14 amu입니다. 실온 및 표준 압력에서, 질소는 무색, 무취 및 맛이없는이 규정형 기체 화합물로 존재합니다.
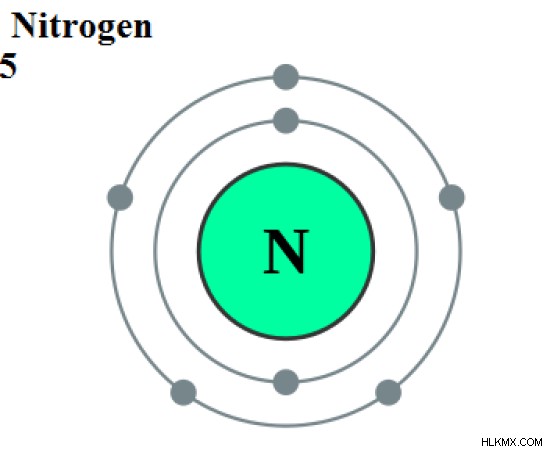
그림 1 :질소의 원자 구조
질소에는 3 개의 짝을 이루지 않은 전자가 있습니다. 전자 쉘을 완성하기 위해 3 개의 공유 결합을 형성하는 경향이 있습니다. 질소는 n < 2 로 존재합니다 대기의 가스. 이는 규정형 공유 화합물입니다. 두 질소 원자 사이에는 트리플 결합이 있습니다.
질소에는 N-14와 N-15의 두 가지 안정적인 동위 원소가 있습니다. 그러나 N-14는 가장 안정적이고 가장 풍부한 동위 원소입니다. 이 동위 원소의 풍부함은 약 99%입니다. 질소는 다양한 화합물을 형성합니다. 일부 예에는 아미드, 아민, 질산염, 질화물, 아 지드, 산화물, 시안화물 등이 있습니다.
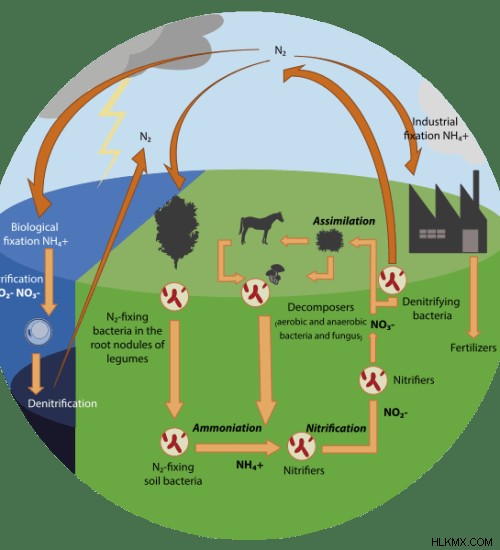
그림 2 :질소 사이클
질소주기는 환경에서 질소의 순환을 보여줍니다. 질소는 지구의 생명에 필수적인 요소입니다. 그것은 핵산, 단백질 등과 같은 많은 중요한 생물학적 분자의 화학적 조성에 포함됩니다. 따라서 질소는 대기, 유기체 내부, 토양에서 발생하며 그들 사이에서 순환합니다.
.질산염이란?
질산염은 화학적 공식 번호 3 를 갖는 음이온입니다. . 이 이온의 몰 질량은 62 g/mol입니다. 공유 화합물입니다. 루이스 구조에는 단일 결합과 이중 결합을 갖는 다른 산소 원자로 질소 원자에 결합 된 2 개의 산소 원자가있다. 따라서 질산염 이온에는 공명 구조가 있습니다. 그러나이 이온의 실제 구조는 모든 공명 구조의 하이브리드 구조입니다. 화합물의 형상은 삼각 평면입니다.
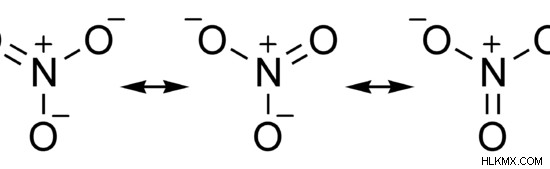
그림 2 :질산염 이온의 공명 구조
질산염 이온을 양성자에 결합 할 때 질산이라고합니다. 질산은 유기 화학에서 대부분의 합성 반응의 핵심 성분입니다. 예를 들어, 니트로 벤젠은 질산, 황산 및 물의 혼합물과 벤젠을 반응함으로써 합성된다.
질산염 이온은 이온 성 화합물에서 염, 유리 수성 이온으로 찾을 수 있습니다. 질산염은 지구상에서 미네랄 침전물로 일반적입니다. 일부 예에는 질산 암모늄, 질산 나트륨, 질산 칼륨 등이 포함됩니다. 질산염은 양이온에 결합 된 질산염 이온으로 구성된 이온 성 화합물입니다. 질산염의 공유 화합물은 질산의 에스테르를 포함한다.
질소주기에서 질화 박테리아 ( nitrobacter ) 아질산염 이온을 질산염 이온으로 변환합니다. 그러나 탈질 박테리아 (예 : pseudomonas ) 질산염을 질소 가스로 변환 할 수 있습니다.
질소와 질산염의 차이
정의
질소 : 질소는 주기율표의 그룹 15의 화학 요소이며 화학 기호“n”을 갖는다.
질산염 : 질산염은 화학적 공식 NO <서브> 3 를 갖는 음이온이다 .
자연
질소 : 질소는 화학 요소입니다.
질산염 : 질산염은 음이온입니다.
전하
질소 : 질소 원자는 순 전하가 없습니다.
질산염 : 질산염 이온은 -1 전하입니다.
질소 사이클
질소 : 질소 원소는 질소주기에서 암모니아, 아질산염 및 질산염과 같은 다른 형태로 순환합니다.
질산염 : 질소주기에서 질화 박테리아는 암모늄 이온을 질산염 이온으로 전환시키는 반면, 탈질 박테리아는 질산염 이온을 질소 가스로 변환합니다.
화합물
질소 : 질소는 무기 화합물 및 유기 화합물을 포함한 다양한 화합물을 형성합니다.
질산염 : 질산염 이온은 염과 공유 화합물에서 발견 될 수 있습니다.
결론
질소는 화학 요소입니다. 질산염 이온은 -1 전하를 갖는 음이온이다. 질소는 질소 이온이 질화 및 탈질 단계에서 발견 될 수있는 반면, 질소는 질소주기에서 순환하는 것을 발견 할 수있다. 질소와 질산염의 주요 차이점은 질소는 화학 요소이고 질산염은 음이온이라는 것입니다.