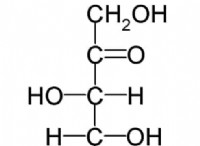
주요 차이 - Fe 2 o 3 vs fe 3 o 4
fe 2 o 3 및 Fe
주요 영역이 적용됩니다
1. fe 2 o 3
- 정의, 속성 및 응용 프로그램
2. fe 3 o 4
- 정의, 화학적 특성
3. Fe 2 의 차이점은 무엇입니까? o 3 및 Fe
- 주요 차이점 비교
핵심 용어 :강자성, 적철광, 철, 마그네타이트, 산화 상태, 산화물, 상자성, 녹

fe 2 o 3
fe 2 o 3 철 (III) 산화물입니다. 무기 화합물 (3 가지 주요 산화철 중 하나)입니다. fe 2 o 3 본질적으로 미네랄 적철광으로 발견됩니다. 적철광은 철강 산업의 주요 철원입니다. fe 2 o 3 무취 인 짙은 빨간색 (벽돌 빨간색) 컬러 솔리드로 나타납니다. fe 2 o 3 상자성입니다. 이것은 강한 외부 자기장에 끌릴 수 있음을 의미합니다. 이 화합물은 산에 의해 쉽게 공격을받습니다. fe 2 의 대체 이름 o 3 "녹"입니다.

그림 1 :Pure Fe 2 o 3 입자
fe 2 의 몰 질량 o 3 159.687 g/mol입니다. 이 화합물의 융점은 1565c이고; 더 높은 온도에서는 일반적으로 분해됩니다. fe 2 o 3 산 및 설탕 용액에 쉽게 용해됩니다. 그것은 물에 불용성입니다.
fe 2 o 3 두 가지 주요 다형성에 존재합니다. 알파 단계 및 감마 단계. Alpha Fe 2 o 3 rmbohedral 구조가 있습니다. 이 구조는 가장 일반적인 형태의 Fe 2 입니다 o 3 . 그것은 적철광이 존재하는 형태입니다. 감마 fe 2 o 3 입방 구조는 덜 일반적입니다. 이 구조는 고온에서 알파 단계에서 형성됩니다. Fe 2 의 다른 단계 o 3 거의 발견되지 않은 베타 단계, 엡실론 단계 등을 포함합니다.
fe 2 의 주요 응용 프로그램 o 3 철 생산 중입니다. 거기, fe 2 o 3 용광로의 공급 원료 (철분이 용융 철의 형태로 생성됨)의 공급 원료로 사용됩니다. 또한, Fe 2 의 매우 미세한 입자 o 3 Rouge in Common으로 알려진 제품의 최종 마무리를 위해 보석을 연마하는 데 사용됩니다.
Fe 3 o 4
fe 3 o 4 철 (II, III) 산화물입니다. Fe와 Fe 이온이 모두 포함되어 있기 때문에 이름이 지정됩니다. 이것은 fe 3 을 만듭니다 o 4 강자성. 이것은 fe 3 를 의미합니다 o 4 약한 외부 자기장에도 끌릴 수 있습니다. Fe

그림 2 :순수한 Fe3O4 입자
fe 3 o 4 어두운 (검은 색) 색상이 있습니다. Fe 3 의 몰 질량 o 4 231.531 g/mol입니다. 이 화합물의 융점은 1597C이고 끓는점은 2623C입니다. 실온에서, 그것은 무취 인 고체 검은 분말입니다. Fe
fe 3 o 4 좋은 전기 도체입니다 (전도도는 Fe 2 의 전도도보다 약 10 배 높습니다. o 3 ). 올바르게 유도되면 Fe
Fe 2 의 차이 o 3 및 Fe 3 o 4
정의
fe 2 o 3 : fe 2 o 3 철 (III) 산화물, 적철광으로도 알려져 있습니다.
fe 3 o 4 : fe 3 o 4 자성석으로도 알려진 철 (II, III) 산화물입니다.
외관
fe 2 o 3 : fe 2 o 3 진한 빨간색 또는 벽돌 빨간 고체 파우더로 나타납니다.
fe 3 o 4 : fe 3 o 4 검은 색 고체 분말로 나타납니다.
철의 산화 상태
fe 2 o 3 : fe 2 o 3 Fe 산화 상태가 있습니다.
fe 3 o 4 : fe 3 o 4 Fe 및 Fe 산화 상태가 모두 있습니다.
몰 질량
fe 2 o 3 : Fe 2 의 몰 질량 o 3 159.687 g/mol.
입니다fe 3 o 4 : Fe 3 의 몰 질량 o 4 231.531 g/mol.
입니다용융점
fe 2 o 3 : fe 2 의 용융점 o 3 1565 ° C
입니다fe 3 o 4 : fe 3 의 용융점 o 4 1597 ° C
입니다비등점
fe 2 o 3 : fe 2 o 3 고온에서 분해.
fe 3 o 4 : Fe 3 의 끓는점 o 4 2623 ° C입니다.
자기 특성
fe 2 o 3 : fe 2 o 3 상자성입니다.
fe 3 o 4 : fe 3 o 4 강자성입니다.
자기장을 향한 매력
fe 2 o 3 : fe 2 o 3 강한 외부 자기장에 끌릴 수 있습니다.
fe 3 o 4 : fe 3 o 4 약한 외부 자기장에도 끌 수 있습니다.
결정 구조
fe 2 o 3 : fe 2 o 3 두 가지 주요 다형성에 존재합니다. 알파 단계, 감마 단계 및 기타 단계. 알파상은 rhombohedral 구조와 감마 Fe 2 를 갖는다 o 3 입방 구조가 있습니다.
fe 3 o 4 : fe 3 o 4 입방, 역 스피넬 구조가 있습니다.
전기 전도도
fe 2 o 3 : fe 2 o 3 Fe 3 와 비교할 때 전기 전도성이 적습니다 o 4 .
fe 3 o 4 : fe 3 o 4 전기 도체가 우수하고 전도도는 Fe 2 의 전도도보다 약 10 배 높습니다. o 3 .
결론
적철광과 자철석은 산업 금속 철 생산 공정에서 철의 주요 원천입니다. 이 미네랄은이 생산의 공급 원료로 사용됩니다. 적철광은 주로 Fe 2 의 형태로 철을 함유한다 o 3 마그네타이트는 Fe
참조 :
1.“철 (III) 산화물.” Wikipedia, Wikimedia Foundation, 2018 년 2 월 11 일, 여기에서 구입할 수 있습니다.
2.“철 (II, III) 산화물.” Wikipedia, Wikimedia Foundation, 2018 년 2 월 10 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. Benjah-BMM27의“철 (III)-산화물 샘플”-Commons Wikimedia
2를 통한 자신의 작업 (공개 도메인). "Fe3o4"Leiem-Commons Wikimedia