산이 물에 용해되면 수소 이온 (H+)을 물 분자에 기증합니다. 산이 기증하는 수소 이온이 많을수록 산도가 높아집니다. 반대로, 염기가 물에 용해 될 때, 그것은 물 분자에서 수소 이온을 받아들입니다. 염기가 수용하는 수소 이온이 많을수록 기본 성이 높아집니다.
산 또는 염기의 강도는 pH 스케일을 사용하여 측정 할 수 있습니다. pH 척도는 0에서 14 사이이며, 7은 중립입니다. 7 미만의 pH는 산성 용액을 나타내고, 7 이상은 기본 용액을 나타냅니다.
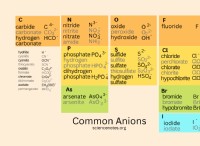
다음은 강산과 염기의 몇 가지 예입니다.
강산 :
- 염산 (HCL)
- 황산 (H2SO4)
- 질산 (HNO3)
강한베이스 :
- 수산화 나트륨 (NAOH)
- 수산화 칼륨 (KOH)
- 수산화 칼슘 (CA (OH) 2)
약산과 염기는 물에 완전히 분리되지 않는 것입니다. 약산 및 염기의 일부 예는 다음과 같습니다.
약산 :
- 아세트산 (ch3cooh)
- 탄산 산 (H2CO3)
- 히드로 플루오르 산 (HF)
약한베이스 :
- 암모니아 (NH3)
- 중탄산 나트륨 (NAHCO3)
- 탄산 칼슘 (CACO3)