주요 차이 - 황 대 이산화황
황은 동종으로 알려진 다른 분자 형태에서 찾을 수있는 비금속입니다. 지구 크러스트에서 밝은 노란색 고체로 발견됩니다. 유황은 대기에서 순수한 요소로 찾을 수 없습니다. 그것은 황의 산화물로 발견됩니다. 대기에서 발견 될 수있는 주요 산화물은 이산화황과 삼중주입니다. 황은 또한 황화수소로서 발견 될 수있다. 황과 이산화황의 주요 차이점은 황은 원소이고 이산화황은 기체 화합물이라는 것입니다.
주요 영역을 다루었습니다
1. 유황이란?
- 정의, 물리적 및 화학적 특성, 사용
2. 이산화황이란?
- 정의, 물리적 및 화학적 특성, 사용
3. 황과 황과 이산화황의 관계는 무엇입니까
- 황과 황색 이산화황
4. 황과 이산화황의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :동종, 비금속, 황, 이산화황, 황 삼산화황
유황이란 무엇입니까
sulfur는 원자 번호가 16이고 기호 S에 주어진 요소입니다.이 요소는 주기성 테이블의 p 블록에 속하며 비금속입니다. 황의 원자량은 약 32 g/mol입니다. 전자 구성은 [ne] 3S3p로 주어질 수 있습니다. 3 껍질에 d 궤도가 있기 때문에 황은 -2에서 +6까지 다른 산화 상태를 가질 수 있습니다. 따라서 황은 다양한 유형의 화합물에서 발견 될 수 있습니다.
실온과 압력에서 황은 견고합니다. 이 고체는 s 8 로 만들어집니다 단위. s 8 의 구조 장치는 다른 형태로 발생할 수 있습니다. 이 형태를 황의 동반 로프라고합니다. s 8 의 가장 일반적인 구조 단위는 크라운 구조와 오후 정열 구조입니다. 황의 녹는 점은 115.21C이고 끓는점은 444.6C입니다.

그림 1 :고체 황
황은 약 25 개의 동위 원소를 가지고 있습니다. 황의 가장 풍부한 동위 원소는 S입니다. 지구상 의이 동위 원소의 풍부함은 약 94%입니다. 황은 다른 유형의 운석에서 황화물 형태로 발견 될 수 있습니다. 대부분의 경우 유황은 온천과 화산 근처에서 발생합니다. 당시의 화산 퇴적물을 채굴하여 황 원소를 얻을 수 있습니다. 황은 실험실 규모뿐만 아니라 산업 규모에 유용한 모든 황 함유 화합물을 생산하는 데 사용됩니다.
이산화황이란?
이산화황은 황과 산소 원자로 구성된 기체 화합물입니다. 이산화황의 화학적 공식은 Sob> 2 입니다 . 따라서, 공유 결합을 통해 2 개의 산소 원자에 결합 된 황 원자로 구성된다. 하나의 산소 원자는 황 원자와 이중 결합을 형성 할 수 있습니다. 따라서, 황 원자는 화합물의 중심 원자이다. 유황 원소는 가장 외부 궤도에 6 개의 전자를 가지기 때문에 산소 원자와 2 개의 이중 결합을 형성 한 후 2 개의 전자가 남아있어 고독한 전자 쌍으로 작용할 수 있습니다. 이것은 So
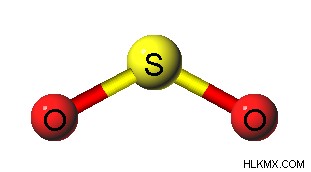
그림 2 :이산화황의 각도 기하학
이산화황은 독성 가스로 간주됩니다. 따라서
이산화황은 황산 연소 과정에서 생성 할 수 있습니다. 그렇지 않은 경우, 황 함유 화합물의 연소는 또한 이산화황을 생성 할 수 있습니다.
s (s) + o 2 (g) → so 2 (g)
이 반응은 발열입니다. 따라서, 이산화황 가스와 함께 에너지를 방출합니다. 이 에너지에서 생성 된 열은 매우 높습니다. 또한 황화 황화제와 같은 황 함유 화합물, 아연 황화제는 이산화황 가스를 방출 할 수 있습니다.
fes 2 (s) + o 2 (g) → fe 2 o 3 (s) + so 2 (g)
이산화황의 황의 산화 상태는 +4입니다. 따라서, 이산화황은 또한 더 높은 산화 상태에있는 황 원자로 구성된 화합물의 환원에 의해 생성 될 수있다. 그러한 예 중 하나는 구리와 황산 사이의 반응이다. 여기서 황산의 황은 +6의 산화 상태에 있습니다. 따라서, 이산화황의 +4 산화 상태로 감소 될 수있다.
.이산화황은 산업 규모와 실험실 규모의 다수의 응용을 갖는 황산의 생산에 사용될 수 있습니다. 이산화황은 또한 좋은 환원제입니다. 황의 산화 상태는 이산화황에서 +4이기 때문에 다른 화합물을 감소시킬 수있는 +6 산화 상태로 쉽게 산화 될 수 있습니다.
.황과 황의 관계
- 산소의 존재하에 고체 황이 연소 될 때 이산화황이 생성됩니다.
황과 이산화황의 차이
정의
황 : 유황은 원자가 16이고 기호에 주어진 요소입니다.
이산화황 : 이산화황은 황과 산소 원자로 구성된 기체 화합물입니다.
산화 상태
황 : 황 원소의 산화 상태는 0입니다.
이산화황 : 이산화황에서 황의 산화 상태는 +4입니다.
상
황 : 유황은 실온에서 고체에 있습니다.
이산화황 : 이산화황은 실온에서 기체상에 있습니다.
질량
황 : 황의 원자 질량은 32 g/mol.
입니다이산화황 : 이산화황의 분자 질량은 64 g/mol.
입니다용융점
황 : 황의 용융점은 약 115.21C입니다.
이산화황 : 이산화황의 용융점은 약 -71c입니다.
비등점
황 : 황의 끓는점은 약 444.6C입니다.
이산화황 : 이산화황의 끓는점은 약 -10C입니다.
결론
황은 실온에서 가스 인 두 가지 주요 산화물을 형성합니다. 그것들은 이산화황과 일산화 황입니다. 이산화황은 황의 연소에서 생성 될 수 있습니다. 이산화황은 또한 황 원자로 구성되지만 다른 화학적 및 물리적 특성을 나타냅니다. 황과 이산화황의 주요 차이점은 황이 요소 인 반면 이산화황은 기체 화합물이라는 것입니다.







