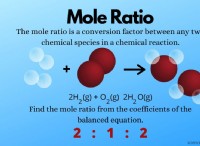
H2SO4 + 2KOH-> K2SO4 + 2H2O
균형 화학적 방정식에서, 우리는 1 몰의 H2SO4가 2 몰의 KOH와 반응 함을 알 수있다. 따라서, 25.0 ml의 1.48 m H2SO4를 중화시키는 데 필요한 KOH의 몰의 수는 다음과 같습니다.
H2SO4 =(25.0 ml / 1000 ml / L) * 1.48 M =0.037 몰 H2SO4
KOH의 두더지 필요 =2 * 0.037 몰 H2SO4 =0.074 몰 KOH
KOH 용액의 몰토리성은 공식을 사용하여 계산할 수 있습니다.
Molarity =Liters의 용액 / 용액의 두더지
사용 된 KOH 용액의 부피 =27.29 ml =0.02729 l
KOH의 몰토리성 =0.074 몰 KOH / 0.02729 L =2.71 M
따라서 KOH 용액의 몰토리성은 2.71 M입니다.