두더지 비율은 화학 반응에서 반응물과 생성물 사이의 고정 비율을 설명합니다. 화학량 론에서, 특히 두더지에서 그램 전환의 변환 계수로 사용될 때는 중요합니다. 두더지 비율 정의는 다음과 같습니다. 비율을 찾고 사용하는 방법을 보여주는 예제가 있습니다.
두더지 비율 정의
두더지 비율은 화학 반응에서 두 물질 사이의 비율입니다. 균형 잡힌 화학 방정식의 두 계수 사이의 비율입니다. 몰비는 어금니 비율 또는 몰 비율이라고도합니다.
균형 방정식에서 두더지 비율 찾기
화학 공식의 계수를 사용하여 화학 반응의 두 성분 사이의 두더지 비율을 찾으십시오. 계수는 공식 앞의 숫자입니다.
예를 들어, 물을 만드는 수소와 산소 사이의 반응에 대한 방정식에서 :
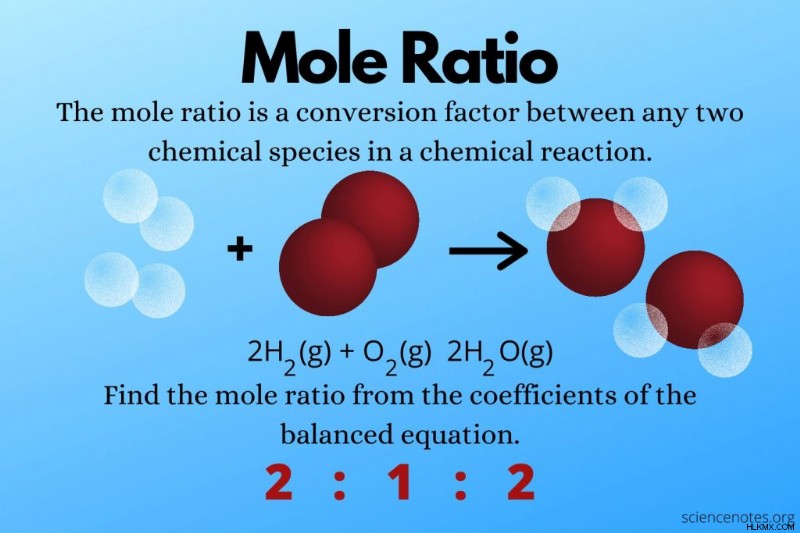
2 h 2 (g) + o 2 (g) → 2 h 2 o (g)
수소의 계수는 2입니다. 산소의 경우 1의 계수가 없습니다. 물의 계수는 2입니다.
수소와 산소 사이의 몰비는 2 :1입니다. 산소와 물 사이의 두더지 비율은 1 :2입니다. 수소와 물의 두더지 비율은 2 :2이지만 이것을 1 :1로 줄일 수 있습니다.
불균형 방정식에서 두더지 비율 찾기
두더지 비율을 작성하려면 균형 방정식이 필요합니다. 불균형 방정식이 주어지면 균형을 맞추는 첫 단계입니다.
예를 들어, 오존을 산소로 변환하는 반응을 고려하십시오.
o 3 → o 2
이 화학 방정식은 불균형입니다. 어떻게 아십니까? 균형 방정식은 반응 화살표의 양쪽에 동일한 수와 유형의 원자를 갖는다. 주어진 방정식에는 화살표의 왼쪽에 3 개의 산소 원자가 있고 화살표 오른쪽에는 2 개의 산소 원자가 있습니다. 원자 수가 양쪽에서 동일 할 때까지 반응물 및 생성물 앞에 계수를 추가하여 방정식의 균형을 맞 춥니 다.
.균형 방정식은 다음과 같습니다.
2o
이제 계수를 사용하여 두더지 비율을 얻으십시오. 비율은 2 개의 오존 분자에서 3 개의 산소 분자 또는 2 :3입니다.
두더지 비율을 사용한 문제
비율은 두 가지 사이의 관계를 보여주는 방법 일뿐입니다. 화학에서 그 중요성은 비율을 사용하여 화학량 론적 문제를 해결할 수 있다는 것입니다.
예를 들어, 4 몰의 오존을 반응하여 얼마나 많은 몰의 산소를 얻는 지 알아 보겠습니다. 이것을 해결하는 한 가지 방법은 동등한 분수와 같은 비율을 설정하는 것입니다.
4 몰 오존 / x 몰스 산소 =2 몰 오존 / 3 몰 산소
"x"에 대한 해결 :
X 몰스 산소 =(4 몰 오존)*(3 몰 산소)/2 몰 오존
X 몰스 산소 =6
오존의 두부에 대한“단위”는 무더미션을 남겨두고 산소를 남깁니다. 작업을 두 번 확인하십시오! 이 계산에서 학생들이 저지르는 가장 일반적인 실수는 단위가 취소되지 않도록 분수를 설정하는 것입니다.
일반적으로 그램으로 값을 얻고 그램으로 답변을 요청받습니다. 두더지 비율은 그램과 같은 질량 단위와 함께 작동하지 않습니다. 따라서 대수와 그램-단독 및 두더지-그램 변환을 수행 할 수 있습니다. 이 모든 기술을 결합하면 연습이 필요합니다.
예를 들어, 0.2 그램의 오존 반응에서 얼마나 많은 산소를 얻는 지 찾으십시오.
- 먼저, 오존에서 산소를 만드는 반응에 대한 균형 잡힌 방정식을 얻으십시오. 이것으로부터 두더지 비율을 쓰십시오.
- 다음으로, 0.2g의 오존에서 두더지 수를 찾으십시오. 두더지에서 그램 전환을하려면 주기율표에서 산소 원자 질량을 찾으십시오. 산소 몰 당 16.00 그램의 산소가 있습니다.
- 전환 문제 해결 :
X 몰스 =0.2 그램 * (1 몰/16.00 그램) =0.0125 Moles - 두더지 비율을 사용하여 0.125 몰의 오존에서 몇 몰의 산소가 형성되는지를 찾으십시오.
산소의 두부 =0.125 몰 오존 * (3 몰 산소/2 몰 오존)
산소의 두부 =0.01875 몰 산소 가스 - 이제 산소 가스 몰을 산소 가스 그램으로 변환하여 최종 답변을 얻으십시오.
산소 가스 그램 =0.01875 몰 * 16.00 그램/몰
산소 가스 그램 =0.3 그램
이 경우, 화학 방정식의 양쪽에서 한 가지 유형의 원자 (산소) 만 발생했기 때문에 실제로 수학을 저장할 수있었습니다. 그러나 모든 단계를 따르는 것이 좋습니다. 또한 올바른 수의 중요한 수치를 사용하여 답변을보고하십시오.
마지막으로, 반응물이나 생성물이 제공 될 수 있으며 동일한 기술을 사용하여 다른 반응물 또는 제품의 양을 찾을 수 있습니다. 때로는 두 가지 수량이 있고 두더지 비율을 사용하여 제한 반응물을 찾습니다.
농도 단위로서의 두더지 비율화학량 론에서, 두더지 비율은 균형 잡힌 화학 방정식에서 종의 몰 사이의 비율이지만, 두더지 비율은 또한 일부 분야에서 농도 단위이기도합니다. 예를 들어, 대기 화학에서, 두더지 비율은 관심있는 구성 요소의 몰을 물질의 총 두더지 수로 나누어 얻은 값입니다.
r i =n i / n tot
여기, r i i 의 두더지 비율입니다 , n i i 의 두더지 수입니다 및 n tot 총 두더지 수입니다. 혼란을 피하기 위해 농도 단위는 두더지 비율이 아닌 두더지 분율로 알려질 수 있습니다.
참조
- iupac (1997) 화학 용어의 개론 ( "골드 북"). (제 2 판). 블랙웰 과학 간행물. ISBN 0-9678550-9-8.







